题目内容
17.下列说法正确的是( )| A. | NH4Cl固体为离子化合物 | |
| B. | CO2分子中含有离子健 | |
| C. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| D. | X2+的核外有18个电子,则X在第四周期第ⅡA族 |
分析 A、氯化铵是离子键形成的离子化合物;
B、二氧化碳是共价键形成的共价化合物;
C、元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个族;
D、阳离子的质子数=核外电子数+电荷数,根据原子结构示意图判断其在周期表中的位置.
解答 解:A、活泼金属和活泼非金属元素之间易形成离子键,所以氯化钠中只存在离子键,故A正确;
B、非金属元素间易形成共价键,二氧化碳中碳元素和氧元素之间只存在共价键,故B错误;
C、元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,Ⅷ族有3个纵行,所以共18个纵行,故C错误;
D、阳离子的质子数=核外电子数+电荷数=18+2=20,X的原子结构示意图为: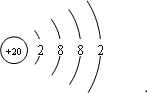 ,所以该元素在第四周期第ⅡA族,故D正确;
,所以该元素在第四周期第ⅡA族,故D正确;
故选AD.
点评 本题考查了化学键、元素周期表等知识点,难度不大,明确Ⅷ族有3个纵行.

练习册系列答案
相关题目
4.1mol H2表示的含义是( )
| A. | 1 mol 氢 | B. | 1 mol 氢气 | C. | 1 mol 氢分子 | D. | 1 mol 氢原子 |
12.用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是( )
| A. | 29.5g | B. | 44g | C. | 59 g | D. | 88g |
2.下列说法正确的是( )
| A. | 焓变单位kJ•mol-1,是指1 mol物质参加反应时的能量变化 | |
| B. | 当反应放热时△H>0,反应吸热时△H<0 | |
| C. | 一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,△H为“-” | |
| D. | 一个化学反应中,当生成物总键能大于反应物的总键能时,反应吸热,△H为“+” |
9.已知:
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+O2(g)═CO2(g)△H1
CO2 (g)+C(s)═2CO(g)△H2
2CO (g)+O2(g)═2CO2(g)△H3
2Cu(s)+O2(g)═2CuO(s)△H4
CO(g)+CuO(s)═CO2(g)+Cu(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>O,△H3<0 | B. | △H2<0,△H4>0 | C. | △H2=△H1-△H3 | D. | △H3=△H4+△H1 |
6.下列离子方程式正确的是( )
| A. | 过氧化钠与水的反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | AlCl3和过量氨水反应:Al3++4OH-═AlO2?+2H2O | |
| C. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+Cl0-+2H+═Cl2↑+H20 | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
7.某溶液中由水电离产生的c(H+)=1×10-10 mol•L-1,该溶液的溶质不可能是( )
| A. | KOH | B. | Na2CO3 | C. | HClO4 | D. | NaHSO4 |
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示:
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示: ;
;