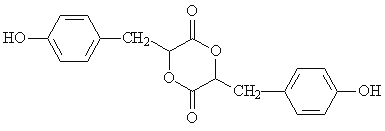
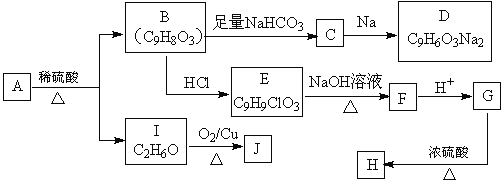
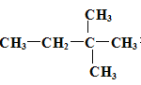
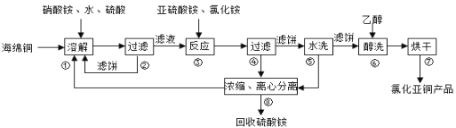
��Ŀ����
����Ŀ����¯���������з�������Ҫ��ӦΪ1/3Fe2O3(s)+CO(g) ![]() 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
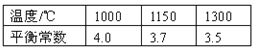
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
��ش��������⣺
��1���÷�Ӧ��ƽ�ⳣ������ʽK= �����������¶����ߣ�ƽ�ⳣ����С����������Ӧ�� �ȷ�Ӧ��������š�����
��2������߷�Ӧ��CO��ƽ��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
A������Fe����
B������Fe2O3����
C���Ƴ�����CO2
D��������ʵĴ���
E�������������ݻ�
��3����һ���ݻ�Ϊ1L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��2.0mol����Ӧ����5min��ﵽƽ�⡣���ʱ�䷶Χ�ڷ�Ӧ��ƽ����Ӧ���ʣ�v (CO2)= ��CO��ƽ��ת����= ����Ҫ��д������̣�
���𰸡���1��c(CO2)/c(CO)���ţ���2��C
��3����COת�������ʵ���Ϊx����
1/3Fe2O3��s��+CO��g���T2/3Fe��s��+CO2��g��
��ʼ����mol�� 2.0 2.0
ת��������mol�� x x
ƽ��ʱ������mol�� 2.0��x 2.0+x
����1000��ʱK=4.0������(2.0+x)/(2.0��x)=4.0�����x=1.2��
CO2��Ũ�ȱ仯��Ϊ��c(CO2)=1.2mol��L��1��
���ö�����̼��ʾ�ķ�Ӧ����Ϊ1.2mol��L��1/5min=0.24mol��(L��min)��1
CO��ת����Ϊ1.2 mol/2 mol��100%=60%
��������
�����������1���÷�Ӧ��ƽ�ⳣ������ʽK=c(CO2)/c(CO) ���¶����ߣ�ƽ�ⳣ����С��˵����Ӧ�����ƶ�����÷�ӦΪ���ȷ�Ӧ��
��2��A��Fe�ǹ��壬�ı������ƽ�ⲻ�ƶ���CO��ƽ��ת�������䣬A����B��Fe2O3�ǹ��壬�ı������ƽ�ⲻ�ƶ���CO��ƽ��ת�������䣬B����C���Ƴ�����CO2��ƽ�������ƶ���CO��ƽ��ת��������C��ȷ��D��������ʵĴ�����ƽ�ⲻ�ƶ���D����E���÷�ӦΪǰ������ϵ������ķ�Ӧ�������������ݻ���ƽ�ⲻ�ƶ���CO��ƽ��ת�������䣬E����ѡC��
��3����COת�������ʵ���Ϊx����
1/3Fe2O3��s��+CO��g���T2/3Fe��s��+CO2��g��
��ʼ����mol�� 2.0 2.0
ת��������mol�� x x
ƽ��ʱ������mol�� 2.0��x 2.0+x
����1000��ʱK=4.0������(2.0+x)/(2.0��x) =4.0�����x=1.2��
CO2��Ũ�ȱ仯��Ϊ��c(CO2)= 1.2 mol��L��1��
���ö�����̼��ʾ�ķ�Ӧ����Ϊ1.2 mol��L��1/5 min =0.24 mol��(L��min )��1
CO��ת����Ϊ1.2 mol/2 mol��100%=60%