题目内容
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
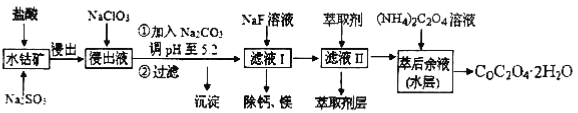
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为
____________________________________________________________________________
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_______________________________________________________
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液=______。
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
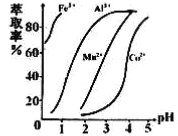
a.1 b.2 c.3 d.4
(6)已知:NH3·H2O![]() NH4++OH- Kb=1.8×10-5;
NH4++OH- Kb=1.8×10-5;
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2;HC2O4-
H++HC2O4- Ka1=5.4×10-2;HC2O4-![]() H++C2O42- Ka2=5.4×10-5;
H++C2O42- Ka2=5.4×10-5;
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
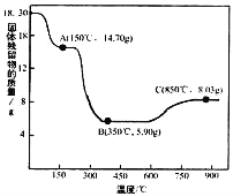
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
【答案】(1)还原Fe3+、Co3+为Fe2+、Co2+
(2)ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
(3)加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用M3+代替)的水解平衡M3++3H2O![]() M(OH)3+3H+,向右移动,而产生氢氧化物沉淀
M(OH)3+3H+,向右移动,而产生氢氧化物沉淀
(4)0.7[Ksp(MgF2)÷Ksp(CaF2)=7.35×10-11÷1.05×10-10=0.7]
(5)c
(6)<)
(7)Co3O4(写成CoO·Co2O3亦给分,但Co2O3·CoO不给分)
【解析】
试题分析:浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;加入NaClO3可得FeCl3,然后加入Na2CO3调PH至5.2,可得Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要有Co2+、Mn2+、Ca2+、Mg2+,加入NaF,除去Ca2+、Mg2+,再在滤液中加入萃取剂,最后得到CoC2O4;
(1)Na2SO3具有还原性,能将Co3+、Fe3+还原;
(2)氯酸钠具有氧化性,能将浸出的亚铁离子氧化成铁离子,自身被还原为氯离子,同时生成水,离子方程式为:ClO2-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+的水解平衡Fe3++3H2O![]() Fe(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
Fe(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)当加入过量的氟化钠后,所得到滤液中镁离子与钙离子的比例等于氟化镁和氟化钙的溶度积的比值,=7.35×10-11/1.05×10-10=0.7;
(5)由萃取剂对金属离子的萃取率与pH的关系图可知,溶液的pH是3.0时Mn2+完全萃取;
(6)因NH3·H2O的Kb大于H2C2O4的Ka2,则(NH4)2C2O4溶液中NH4+比C2O42-的水解能力弱,溶液显酸性。
(7)由题意知,二水合草酸钴(CoC2O42H2O)的起始质量是18.3g,物质的量为0.1mol,其中Co元素的质量是5.9g,300℃时该固体分解为Co的氧化物,C点固体质量为8.03g,则O元素的质量是8.03g-5.9g=2.13g,物质的量是2.13g/16gmol-1=0.133125mol,则该固体中Co与O原子的物质的量之比是0.1: 0.133125=3:4,C点剩余固体的化学成分为Co3O4。