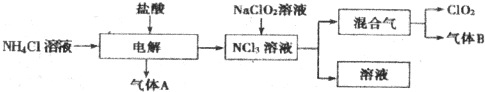
题目内容
19.“蛟龙”号外壳用特殊的钛合金材料制成,它可以在深海中承受700个大气压的压力.已知金属钛的原子序数为22,化学性质与铝类似.下列说法正确的是( )| A. | 钛属于主族元素 | |
| B. | 钛合金强度很大 | |
| C. | 蒸干TiCl4溶液可得无水钛盐 | |
| D. | 在空气中将金属钛、铝混合后熔化可制得合金 |
分析 A、金属钛的原子序数为22,位于第四周期第IIB族;
B、钛合金强度很大,可以在深海中承受700个大气压的压力;
C、TiCl4是强酸弱碱盐,蒸干水解生成的氯化氢挥发,促进水解,得到氢氧化钛;
D、在空气中加热金属易被氧化.
解答 解:A、金属钛的原子序数为22,位于第四周期第IIB族,不是主族元素,故A错误;
B、钛合金可以在深海中承受700个大气压的压力,钛合金强度很大,故B正确;
C、TiCl4是强酸弱碱盐,蒸干水解生成的氯化氢挥发,促进水解,得到氢氧化钛,得不到钛盐,故C错误;
D、在空气中加热熔化,金属易与氧气发生反应,所以不能直接在空气中制备钛铝合金,故D错误;
故选B.
点评 本题考查元素在周期表中的位置、合金的性质和盐的水解的知识,综合性强,但难度适中,比较容易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列说法不正确的是( )
| A. | 二氯丙烷有三种同分异构体 | |
| B. | 碳酸氢钠可用作食品加工中的无铝发泡剂,快速发酵粉 | |
| C. | 二氧化碳制全降解塑料有助于控制温室效应和白色污染 | |
| D. | 某化合物的分子式为C8H10O,其中能与乙酸发生酯化反应的同分异构体有4种 |
10.下列离子方程式书写正确的是( )
| A. | 向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I-=3I2+2H2O | |
| B. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| C. | a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2=2I2+2Fe3++6C1- | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
7.下列有关实验的叙述,正确的是( )
| A. | 燃着的酒精灯不慎碰到失火,应立即用湿布盖灭 | |
| B. | 酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗 | |
| C. | 用浓氨水洗涤做过银镜反应的试管 | |
| D. | 测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比 |
14.某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)?2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):下列说法正确的是( )
| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
11.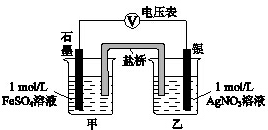 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
注:经检验黑色固体为Ag
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
①实验Ⅲ不能(填“能”或“不能”)证明Fe3+氧化了Ag,理由是因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag.
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
 为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:已知:相关物质的溶解度(20°C)AgCl:1.5×10-4g Ag2SO4:0.796g
(1)甲同学的实验如下:
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 将2mL 1mol/L AgNO3溶液加入到 1mL 1mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
| 取上层清液,滴加KSCN溶液 | 溶液变红 |
①白色沉淀的化学式是Ag2SO4.②甲同学得出Ag+氧化了Fe2+的依据是有黑色固体(Ag)生成,加入KSCN溶液后变红.
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ.
a.按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.偏移的方向表明:电子由石墨经导线流向银.放置一段时间后,指针偏移减小.
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:
偏移减小→回到零点→逆向偏移.
①a中甲烧杯里的电极反应式是Fe2+-e-=Fe3+.
②b中电压表指针逆向偏移后,银为负极(填“正”或“负”).
③由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
| 序号 | 操作 | 现象 |
| 实验Ⅲ | 将2mL 2mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
| 实验Ⅳ | 将2mL1mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
| 实验Ⅴ | 将2mL 2mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
②用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:溶液中存在平衡:Fe3++Ag=Fe2++Ag+,且AgCl比Ag2SO4溶解度更小,Cl-比SO42-更有利于降低Ag+浓度,所以实验Ⅴ比实验Ⅳ正向进行的程度更大.
8.下列说法不正确的是( )
| A. | C2H4和C2H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3种二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
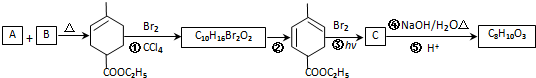
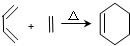 ,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2
,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2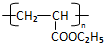 .
.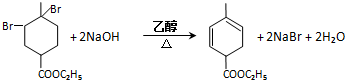 .
.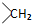 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为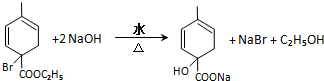 .
.