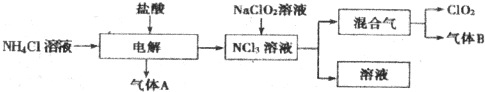
题目内容
4.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )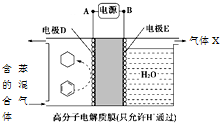
| A. | A为电源的正极 | |
| B. | 气体X是H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
分析 根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极;该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,由此分析解答.
解答 解:A、B是电源的正极,故A错误;
B、阳极上氢氧根离子放电生成氧气,故B错误;
C、苯中的碳得电子生成环己烷,则D作阴极,E作阳极,故C错误;
D、该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故D正确;
故选D.
点评 本题考查电解池原理,熟悉电解池工作原理是解题关键,题目难度较大.

练习册系列答案
相关题目
14.某温度T1时,向容积为2L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)?2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):下列说法正确的是( )
| 反应时间/min | n(H2)/mol | n(I2)/mol |
| 0 | 0.9 | 0.3 |
| t1 | 0.8 | |
| t2 | 0.2 |
| A. | 反应在t1 min内的平均速率为:v(H2)=$\frac{0.1}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变 | |
| C. | 保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol | |
| D. | 升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应 |
15.关于下列各装置图(略去部分夹持仪器)的叙述中,正确的是( )
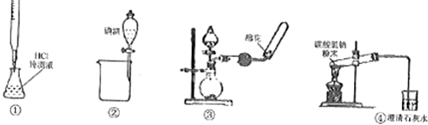

| A. | 利用装置①进行盐酸待测溶液浓度的测定 | |
| B. | 利用装置②分离碘酒中碘和酒精 | |
| C. | 利用装置③制备收集干燥氨气 | |
| D. | 利用装置④加热分解碳酸氢钠 |
12.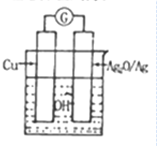 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
下列有关说法不正确的是( )
 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法不正确的是( )
| A. | 工业上制备水泥的原料有黏土、石灰石、石膏 | |
| B. | 测量原理装置图中Ag2O/Ag极发生还原反应 | |
| C. | 负极的电极反应式为2Cu+H2O-2e-=Cu2O+2H+ | |
| D. | 在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化 |
19.将铁片分别加入下列溶液中,铁片能溶解且溶液质量减轻的是( )
| A. | CuSO4 | B. | Fe2(SO4)3 | C. | 稀HNO3 | D. | Al2(SO4)3 |
10.可用来鉴别己烯、苯酚、甲苯、乙酸乙酯溶液的一组试剂是( )
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |
7.在下列条件下,能大量共存的微粒组是( )
| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
8.下列说法不正确的是( )
| A. | 碳酸钠常用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 切开的金属Na暴露在空气中,光亮表面会逐渐变暗 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 金属钠着火时,可以使用泡沫灭火器来灭火 |