题目内容
4.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:①a、c、e皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
分析 在金属活动性顺序表中,位于氢之前的金属能和稀盐酸或稀硫酸反应生成氢气,较活泼金属能置换出较不活泼金属;
这几种金属中只有Al能和强碱反应生成氢气;
常温下,铝和Fe能和浓硫酸发生钝化现象,据此判断金属性单质.
解答 解:在金属活动性顺序表中,位于氢之前的金属能和稀盐酸或稀硫酸反应生成氢气,根据①知,a、c、e属于Fe、Al、Mg中的一种;
这几种金属中只有Al能和强碱反应生成氢气,根据③知,c是Al;
常温下,铝和Fe能和浓硫酸发生钝化现象,根据④知,e是Fe;
所以a是Mg;
b、d分别是Ag、Cu中的一种,较活泼金属能置换出较不活泼金属,活泼性Cu>Ag,根据②知,b是Cu、d是Ag;
通过以上分析知,a、b、c、d、e依次为Mg、Cu、Al、Ag、Fe,
故选C.
点评 本题考查金属活动性顺序判断,明确金属活动性顺序表及金属单质性质是解本题关键,高中阶段学习的金属单质只有Al能和强碱溶液反应生成氢气,题目难度不大.

练习册系列答案
相关题目
12.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | PCl3 | B. | H2S | C. | BeCl2 | D. | SF6 |
13.下表是四个反应的有关信息:
下列结论正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A. | 第①组反应的氧化产物一定只有FeCl3(实为Fe3+) | |
| B. | 第③组反应的产物还有KCl和H2O | |
| C. | 氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ | |
| D. | 还原性比较:H2O2>Mn2+>Cl- |
9.用4种溶液进行实验,下表中“操作及现象”与“溶液”不符的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 缓慢通入反应C+2H2O+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl生成的气体,变浑浊,继续通入,浑浊消失 | Ca(OH)2溶液 |
| B | 通入SO2和SO3混合气体,溶液变浑浊,无任何气体生成 | Ba(NO3)2溶液 |
| C | 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| D | 通入(NH4)2CO3受热分解产生的气体,变浑浊,继续通入,浑浊不消失 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
16.下列分子中的中心原子杂化轨道的类型相同的是( )
| A. | SO3与HCHO | B. | BF3与NH3 | C. | BeCl2与SCl2 | D. | H2O与SO2 |
13.下列分子中所有原子都满足最外层8电子稳定结构的是( )
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 二氧化氯(ClO2) |
14.下列各组物质,无论前者是否过量,都能用同一离子方程式表示的是( )
| A. | 稀盐酸,Na2CO3溶液 | B. | 硫酸铝溶液,氨水 | ||
| C. | 碳酸氢钠溶液,澄清石灰水 | D. | 二氧化碳,氢氧化钠溶液 |
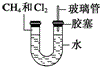 如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间.