题目内容
3. 化学反应原理在工业生产中具有十分重要的意义.
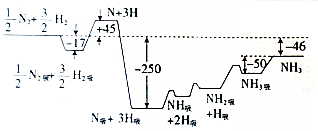
化学反应原理在工业生产中具有十分重要的意义.(1)T=673K时,合成氨反应过程中的能量变化如图所示,图中的能量单位为kJ•mol-1,“吸”表示在催化剂表面的吸附.
①合成氨反应的机理为:
A.H2?H2吸?2H?2H吸;
B.N2吸?2N?2N吸;
C.N吸+H吸?NH吸;
D.NH吸+H吸?NH2吸;
E.NH2吸+H吸?NH3吸?NH3.
②T=673K时,合成氨反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);H=-92kJ•mol-1.
分析 (1)①根据图和已有的机理,可推断出A、D两个反应;
②由图可以看出生成1molNH3,△H=-46kJ•mol-1,气体分子数改变的反应,在一定体积的容器中,压强保持不变是平衡状态.
解答 解:(1)由图可知该反应的机理是H2→H2吸→2H→2H吸,N2吸→2N→2N吸,N吸+H吸→NH吸→NH2吸→NH3吸→NH3,
则A的反应为N2吸?2N?2N吸,
D的反应为NH吸+H吸?NH2吸;
故答案为:N2吸?2N?2N吸;NH吸+H吸?NH2吸;
②由图可以看出生成1molNH3,△H=-46kJ•mol-1,则反应的热化学方程式为N2(g)+3H2(g)?2NH3(g);H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g);H=-92kJ•mol-1.
点评 本题很好的将化学平衡、电离平衡、反应热结合在一块,虽然题目引入了诺贝尔奖的有关背景,但高起点低落点,这种命题方法是高考的常用方法,一定要考虑清楚是否运用信息或搞清楚哪些是干扰信息.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
13.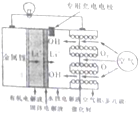 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
14.已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L-1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是( )
| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
11.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)写出①~⑨九种元素的元素符号C,N,O,Na,Al,S,Cl,Ar,K
(2)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: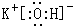 .
.
(4)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥的化合物的形成过程: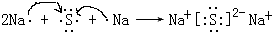 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(6)表示①与③的化合物的电子式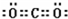 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在这些元素中,化学性质最不活泼的是:Ar(填元素符号).
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是:
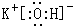 .
.(4)最高价氧化物是两性氧化物的元素是Al(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥的化合物的形成过程:
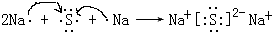 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(6)表示①与③的化合物的电子式
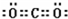 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
18.下列事实中,不能说明氯原子得电子能力比硫原子强的是( )
| A. | 盐酸的酸性比氢硫酸(H2S水溶液)酸性强 | |
| B. | Cl2与铁反应生成FeCl3,而S与铁反应生成FeS | |
| C. | Cl2能与H2S反应生成S | |
| D. | 还原性:Cl-<S2- |
8.下列解释事实的方程式正确的是( )
| A. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
15.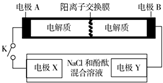 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
 某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )
某二次电池充、放电的化学方程式为:2K2S2+KI3$→_{充电}^{放电}$K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )| A. | K+从右到左通过离子交换膜 | |
| B. | A的电极反应式为:3I--2e-=I3- | |
| C. | 当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下) | |
| D. | 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应 |
13.下列说法正确的是( )
| A. | CH2O2和C3H6O2一定互为同系物 | |
| B. | 碳酸钠溶液可用于鉴别乙酸和乙酸乙酯 | |
| C. | 用溴水可以除去溶解在苯中的少量苯酚 | |
| D. | 粮食酿酒过程中,淀粉在酶的催化作用下最终水解为乙醇 |
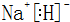 .
.