题目内容
14.已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L-1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是( )| A. | 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大 | |
| B. | 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H+) | |
| C. | 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4)+c(HC2O4- )+c(C2O42-)] |
分析 NaHC2O4溶液显弱酸性,说明HC2O4-的电离程度大于其水解程度,
A.加入H2C2O4固体后,溶液中氢离子浓度增大,抑制了水的电离;
B.恰好反应后生成Na2C2O4,C2O42-部分水解,溶液显示碱性,由于氢离子来自水的电离和C2O42-的水解,则c(H+)>c(HC2O4-);
C.溶液为中性,则c(H+)>c(OH-),根据溶液中的电荷守恒判断;
D.根据混合液中的物料守恒分析.
解答 解:NaHC2O4溶液显弱酸性,说明HC2O4-的电离程度大于其水解程度,
A.酸溶液抑制了水的电离,加入H2C2O4固体后,溶液中氢离子浓度增大,则水的电离程度减小,抑制了水的电离,故A错误;
B.加入NaOH溶液至恰好完全反应生成Na2C2O4,C2O42-部分水解,溶液显示碱性,由于氢离子来自水的电离和C2O42-的水解,则c(H+)>c(HC2O4-),正确的离子浓度大小为:c(Na+)>c(C2O42-)>c(H+)>c(HC2O4-),故B错误;
C.中性溶液中c(H+)>c(OH-),根据电荷守恒可得:c(NH4+)+c(Na+)=2c(C2O42-)+c(HC2O4-),故C正确;
D.加入0.01 mol Na2C2O4固体,混合液中含有等浓度的Na2C2O4和NaHC2O4,根据物料守恒可得:2c(Na+)=3[c(H2C2O4)+c(HC2O4- )+c(C2O42-)],故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,注意掌握判断离子浓度大小常用方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
5.下列对事实的解释或结论不正确的是( )
| 事实 | 解释或结论 | |
| A | 向Na2CO3浓溶液中通入足量CO2溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| B | 常温下相同浓度NaHCO3溶液的pH大于NaHSO3的pH | 酸性:H2CO3<H2SO3 |
| C | 向2mL 1mol/LAlCl3溶液中加入几滴1mol/LNaOH溶液,生成白色沉淀,再加入几滴1mol/LFeCl3溶液,沉淀变为红褐色 | Ksp:Al(OH)3>Fe(OH)3 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法不正确的是( )
| A. | 乙二醇用于汽车防冻液 | |
| B. | 麦芽糖在水解前后均能发生银镜反应 | |
| C. | 1-氯丙烷和2-氯丙烷发生消去反应的产物不同 | |
| D. | H2N-CH2-COOH的缩聚产物中含  结构 结构 |
19.重铬酸钾(K2Cr2O7)俗称红矾钾,是工业生产和实验室的重要氧化剂.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
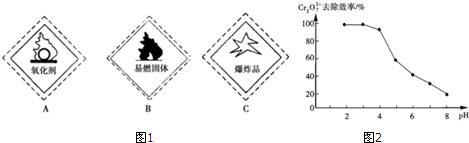
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)
(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+ Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
①阴极的电极反应式为2H++2e-=H2↑;Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,电路中每转移6mol电子,最多有0.5mol Cr2O72-被还原.
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)

(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
6.下列不属于化学电源的是( )
| A. | 干电池 | B. | 锂电池 | C. | 太阳能电池 | D. | 铅蓄电池 |
4.分子式为C4H9ClO的有机物,能与金属钠反应放出氢气的同分异构体数目有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)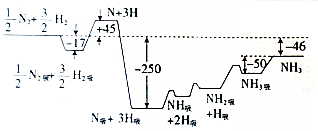 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.