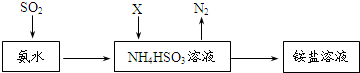
题目内容
8.下列解释事实的方程式正确的是( )| A. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
分析 A.铝还原性大于铁,铝与氧化铁在高温下发生反应生成铁和氧化铝;
B.离子方程式两边正电荷不相等,不满足电荷守恒;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.硅酸钠为强电解质,离子方程式中需要拆开.
解答 解:A.铝在高温下能够将氧化铁还原成铁,所以利用铝热反应可焊接钢轨,反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3,故A正确;
B.用氯水除去FeCl3溶液中的Fe2+,正确的离子方程式为Cl2+2Fe2+═2Cl-+2Fe3+,故B错误;
C.用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度,醋酸不能拆开,正确的离子方程式为CH3COOH+OH-═CH3COO-+H2O,故C错误;
D.盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是二氧化硅与氢氧化钠溶液反应生成硅酸钠,正确的离子方程式为SiO2+2OH-═SiO32-+H2O,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
相关题目
19.重铬酸钾(K2Cr2O7)俗称红矾钾,是工业生产和实验室的重要氧化剂.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
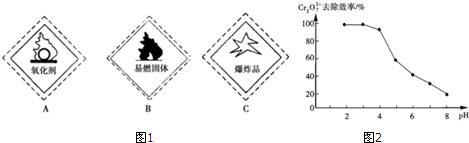
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)
(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+ Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
①阴极的电极反应式为2H++2e-=H2↑;Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O,电路中每转移6mol电子,最多有0.5mol Cr2O72-被还原.
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
已知K2Cr2O7溶液中存在平衡Cr2O72-+H2O?2CrO42-+2H+.
回答下列问题(残留在溶液中的离子浓度小于1×10-5 mol•L-1时,该离子视为沉淀完全):
(1)重铬酸钾试剂标签上应标注(图1)A.(填字母编号)

(2)加热时,重铬酸钾与浓盐酸反应,使氯离子氧化逸出,请写出该反应的离子方程式:14H++Cr2O72-+6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
(3)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12.分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀AgCl,达到滴定终点的实验现象为:滴最后一滴AgNO3溶液时,生成砖红色沉淀.该沉淀滴定需要注意两个问题:
①指示剂的用量,滴定终点时,溶液中的CrO42-浓度为2.8×10-3 mol•L-1时合适;
②控制溶液的酸度,pH在6.5-10.5之间,请结合反应方程式分析,为什么pH<6.5实验结果将不准确:2CrO42-+2H+
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.(4)人体内铬元素的含量过高,会引起急性中毒,甚至致癌.工业上可采用铁作阳极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Fe(OH)3和Cr(OH)3沉淀,从而使废水中铬含量低于排放标准.下表是常温下金属氢氧化物的Ksp和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度)[Cr(OH)3是一种两性氢氧化物].
| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
②pH对废水中Cr2O72-去除效率的影响情况如图2所示.电解过程中对降低废水中的铬含量最有利的pH范围为4.3~5.6.
16.某学生将电流表用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )
| A. | 用铜片、铅笔芯作电极插入稀硫酸中 | |
| B. | 用两个铜片作电极插入硝酸银溶液中 | |
| C. | 用锌片、铜片作电极插入番茄中 | |
| D. | 用铜片、铁片作电极插入酒精中 |
13.硒(Se)与硫在元素周期表中位于同一主族.下列说法不正确的是( )
| A. | 原子半径:Se>S | B. | 沸点:H2S>H2Se | ||
| C. | 稳定性:H2S>H2Se | D. | 酸性:H2SO4>H2SeO4 |
20.下列叙述正确的是( )
| A. | SO32-中硫原子的杂化方式为sp3 | B. | H2O分子中氧原子的杂化方式为sp2 | ||
| C. | BF3分子呈三角锥体空间型 | D. | C2H2分子中含有3个σ键和2个π键 |
18.下列关于实验现象解释不正确的是( )
| A | B | C | D | |
| 操作与现象 | 放在石棉网上的钠在空气中燃烧生成黑色固体 | 铜与稀硝酸反应试管内产生红棕色气体 | 0.5mol/L的CaCl2滴入0.5mol/L的NaHCO3中产生白色沉淀 | Cu与浓硫酸反应生成白色及少量黑色沉淀物 |
| 解释 | 生成固体物质有大量的碳 | 反应产生的NO与试管内的空气反应 | 反应2HCO3-+Ca2+=CaCO3↓+H2O+CO2↑ | 白色沉淀是CuSO4黑色沉淀是Cu2O |
| A. | A | B. | B | C. | C | D. | D |
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献. 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.