题目内容
用4种溶液进行实验,下表中“试剂和操作”与“现象”对应关系正确的是
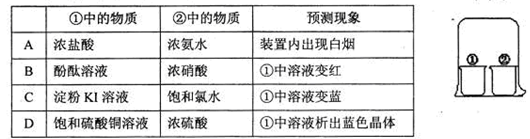
| 选项 | 试剂和操作 | 现象 |
| A | 向AlCl3溶液中滴入过量的氨水 | 溶液先有白色沉淀,后来沉淀消失 |
| B | 向新生成的AgC1浊液中滴入KI溶液,振荡 | 白色沉淀逐渐转化为黄色沉淀 |
| C | 向Ca(C1O)2溶液中先通入CO2,再加入少量品红溶液 | 溶液先变浑浊,通入CO2后品红的红色不褪去 |
| D | 向BaC12溶液中先通入SO2,再通入过量NO2 | 先生成沉淀,后来沉淀消失 |
B
解析试题分析:由于氢氧化铝是两性氢氧化物,氨水的碱性比氢氧化铝强,则AlCl3+3NH3?H2O=Al(OH)3↓+3NH4Cl,由于一水合氨是弱碱,氢氧化铝不能溶于过量的氨水,因此先产生白色沉淀,后沉淀不溶解,故A选项错误;由于溶解度(S)或溶度积(Ksp):AgCl>AgI,AgCl浊液中存在如下沉淀溶解平衡:AgCl(s) Ag++Cl—,滴入KI溶液时,I—与Ag+结合生成更难溶、黄色的AgI沉淀,减小银离子浓度,促进AgCl溶解平衡向正反应方向移动,白色沉淀变为黄色沉淀,故B选项正确;由于碳酸的酸性比次氯酸强,则Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,由于次氯酸具有强氧化性,能使品红溶液褪色,故C选项错误;盐酸的酸性比亚硫酸强,BaCl2溶液中重通入SO2时无明显现象,由于NO2具有强氧化性,能将SO2氧化为硫酸根离子,因此再通入NO2时,产生白色的硫酸钡沉淀,故D选项错误。
Ag++Cl—,滴入KI溶液时,I—与Ag+结合生成更难溶、黄色的AgI沉淀,减小银离子浓度,促进AgCl溶解平衡向正反应方向移动,白色沉淀变为黄色沉淀,故B选项正确;由于碳酸的酸性比次氯酸强,则Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,由于次氯酸具有强氧化性,能使品红溶液褪色,故C选项错误;盐酸的酸性比亚硫酸强,BaCl2溶液中重通入SO2时无明显现象,由于NO2具有强氧化性,能将SO2氧化为硫酸根离子,因此再通入NO2时,产生白色的硫酸钡沉淀,故D选项错误。
考点:考查常见无机物的主要性质,涉及氢氧化铝的两性、氯化银沉淀溶解平衡的移动、沉淀的转化、次氯酸的弱酸性和强氧化性、二氧化氮的强氧化性、二氧化硫的还原性、亚硫酸与盐酸的酸性等。

练习册系列答案
相关题目
下列叙述正确的是
| A.NaHCO3固体中既含有离子键,又含有共价键,溶于水后的电离方程式为 NaHCO3=Na++H++CO32- |
B.符合a b b c转化关系的单质a可以是N2、Al、Si、S c转化关系的单质a可以是N2、Al、Si、S |
| C.室温下,pH=3的溶液中,Na+、Fe2+、NO3-、AlO2-四种离子不能大量共存 |
| D.用焰色反应或澄清石灰水均可鉴别Na2CO3与KHCO3溶液 |
下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Fe2(SO4)3可以做净水剂 | Fe 3+水解成胶体可吸附水中的细小悬浮物 |
| B | 向Ba(NO3)2溶液中通入足量SO2,无明显现象 | 弱酸不能制强酸 |
| C | Cl2能使湿润的布条褪色 | Cl2具有漂白性 |
| D | 电解NaCl溶液制备金属钠 | NaCl是离子化合物 |
下列说法不正确的是
| A.将Na2O2投入NH4CI溶液中只可能生成一种气体 |
| B.铁分别与稀盐酸和硫反应,产物中铁元素的化合价相同 |
| C.向饱和ZnS溶液中加入Na2S有沉淀析出,但KSP(ZnS)不变 |
| D.在滴有酚酞的Na2CO3溶液中,加入适量BaCl2溶液后溶液退色 |
固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3, AgN03中的一种或几种组成,某同学对该固体进行了如下实验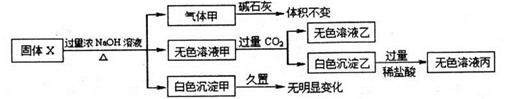
下列判断正确的是:
| A.气体甲一定是纯挣物 |
| B.白色沉淀甲可能是混合物 |
| C.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2 |
| D.固体X中一定不存在FeCl2、AgNO3 |
有关元素X、Y、Z、D、E的信息如下:
| | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074 nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102 nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物可溶于水,且能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为___________。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_______。
①保存EY2溶液时,需向溶液中加入少量E单质
②EY2只能通过置换反应生成,EY3只能通过化合反应生成
③铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)将Z单质在X的单质中燃烧的产物和等物质的量的Y单质同时通入足量的水中,充分反应后的溶液中滴入品红溶液,现象是__________________,有关反应的离子方程式为________________________________________________________________________。