题目内容
下列叙述正确的是
| A.NaHCO3固体中既含有离子键,又含有共价键,溶于水后的电离方程式为 NaHCO3=Na++H++CO32- |
B.符合a b b c转化关系的单质a可以是N2、Al、Si、S c转化关系的单质a可以是N2、Al、Si、S |
| C.室温下,pH=3的溶液中,Na+、Fe2+、NO3-、AlO2-四种离子不能大量共存 |
| D.用焰色反应或澄清石灰水均可鉴别Na2CO3与KHCO3溶液 |
C
解析试题分析:A、碳酸氢钠是弱酸的酸式盐,其电离方程式是NaHCO3=Na++HCO3-,A不正确;B、N2+O2=2NO、2NO+O2=2NO2;4Al+3O2=2Al2O3,氧化铝与氧气不反应;Si+O2=SiO2,二氧化硅与氧气不反应;S+O2=SO2、2SO2+O2=2SO3,所以选项B不正确;C、室温下,pH=3的溶液显酸性,则AlO2-不大量共存。在酸性条件下,NO3-能氧化Fe2+不能大量共存,C正确;D、Na2CO3与KHCO3溶液均能和澄清石灰水反应生成白色沉淀碳酸钙,不能鉴别,D不正确,答案选C。
考点:考查电离方程式、物质的转化、离子共存以及物质的鉴别等

练习册系列答案
相关题目
下列叙述中正确的是
| A.干燥的Cl2和氯水均能使鲜花褪色 |
| B.向碘水中通入SO2,碘水褪色说明SO2具有漂白性 |
| C.向FeBr2溶液中滴加少量氯水,溶液变浅黄色是因为生成了Br2 |
| D.将Cl2通入AgNO3溶液中不会有沉淀产生 |
下列各组物质,不能按照关系X—Y—Z—X(“—”表示反应一步完成)相互转化的是
| 物质 | A | B | C | D |
| X | CaO | BaCl2 | Cu(NO3)2 | K2SO4 |
| Y | CaCl2 | Ba(NO3)2 | Cu(OH)2 | KCl |
| Z | CaCO3 | BaCO3 | CuSO4 | KNO3 |
下列说法正确的是
| A.高纯度的二氧化硅能用于制光导纤维,光导纤维遇强碱会“断路” |
| B.向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水,现象不同 |
| C.常温下,使湿润的KI淀粉试纸变蓝色的气体为氯气 |
| D.标准状况下,11.2LNO2和11.2LN2O4的混合物中所含的分子数为9.03×1023个 |
右下图为与水相关的部分转化关系(水作反应物或生成物,部分产物和反应条件未列出)。下列说法错误的是
| A.右图所示的反应均为氧化还原反应 |
| B.比较镁、铁与水的反应条件,可知铁的金属性比镁弱 |
| C.工业上常用NO2与水的反应原理制取硝酸 |
| D.实验室中可用铜与稀硝酸反应制取NO2 |
下列物质的转化在给定条件下能实现的是
①SiO2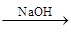 Na2SiO3
Na2SiO3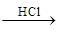 H2SiO3
H2SiO3
②Fe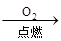 Fe2O3
Fe2O3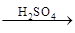 Fe2(SO4)3
Fe2(SO4)3
③BaSO4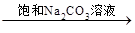 BaCO3
BaCO3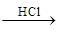 BaCl2
BaCl2
④AlCl3 Al
Al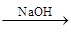 NaAlO2
NaAlO2
⑤HCHO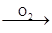 HCOOH
HCOOH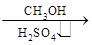 HCOOCH3
HCOOCH3
| A.①②③ | B.②③⑤ | C.③④⑤ | D.①③⑤ |
下列叙述正确的是
| A.CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B.铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C.FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D.在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
下列有关元素及其化合物的说法错误的是
| A.Na2O和Na2O2组成元素相同,化学性质也相同 |
| B.往FeCl3溶液中滴入KI―淀粉溶液,溶液变蓝色 |
| C.Si、P、S、Cl的得电子能力及其最髙价氧化物对应水化物的酸性均依次增强 |
| D.在常温下,浓硫酸、浓硝酸与铁均可发生钝化,故能用铁罐储运 |
用4种溶液进行实验,下表中“试剂和操作”与“现象”对应关系正确的是
| 选项 | 试剂和操作 | 现象 |
| A | 向AlCl3溶液中滴入过量的氨水 | 溶液先有白色沉淀,后来沉淀消失 |
| B | 向新生成的AgC1浊液中滴入KI溶液,振荡 | 白色沉淀逐渐转化为黄色沉淀 |
| C | 向Ca(C1O)2溶液中先通入CO2,再加入少量品红溶液 | 溶液先变浑浊,通入CO2后品红的红色不褪去 |
| D | 向BaC12溶液中先通入SO2,再通入过量NO2 | 先生成沉淀,后来沉淀消失 |