题目内容
10.对下列电解质溶液的叙述错误的是( )| A. | 等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| B. | 25℃时 0.2 mol•L-1盐酸与等体积0.05 mol.L-1Ba(OH)2溶液混合后,溶液的pH=l | |
| C. | 25℃时,pH=3的二元弱酸H2R溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) | |
| D. | 25℃时,若0.3 mol.L-1 HY溶液与0.3 mol.L-lNaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=1×lO-9 mol.L-1 |
分析 A.CO32-水解程度大于HCO3-,二者都水解导致溶液呈碱性;
B.盐酸中氢离子浓度是氢氧化钡中氢氧根离子浓度2倍,二者等体积混合,盐酸有剩余,溶液中的溶质是等物质的量浓度的HCl和BaCl2,混合溶液中c(H+)=$\frac{0.2mol/L-0.05mol/L×2}{2}$=0.05mol/L;
C.25℃时,混合溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒判断;
D.25℃时,等物质的量的HY和NaOH混合,溶液pH=9>7,溶液呈碱性,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.CO32-水解程度大于HCO3-,二者都水解导致溶液呈碱性,钠离子不水解,且离子水解程度都较小,所以离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故A正确;
B.盐酸中氢离子浓度是氢氧化钡中氢氧根离子浓度2倍,二者等体积混合,盐酸有剩余,溶液中的溶质是等物质的量浓度的HCl和BaCl2,混合溶液中c(H+)=$\frac{0.2mol/L-0.05mol/L×2}{2}$=0.05mol/L,则溶液的pH>1,故B错误;
C.25℃时,混合溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒,根据电荷守恒得2c(R2-)+c(HR-)=c(Na+),故C正确;
D.25℃时,等物质的量的HY和NaOH混合,溶液pH=9>7,溶液呈碱性,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(Y-)+c(OH-),根据物料守恒得c(Na+)=c(Y-)+c(HY),所以得c(OH-)-c(HY)=c(H+)=1×lO-9 mol.L-1,故D正确;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确混合溶液中的溶质及其性质、溶液酸碱性是解本题关键,结合电荷守恒、物料守恒解答,易错选项是D,注意微粒关系之间的转化.

| A. | 可由石油裂解制取 | B. | 通过加聚反应可制得保鲜膜 | ||
| C. | 通过加成反应可制得氯乙烯 | D. | 能使溴水和酸性高锰酸钾溶液褪色 |
| A. | pH=1的溶液中:K+、Cr2O72-、C6H5OH、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Cu2+、Na+、Cl-、SO42- | |
| C. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、Cl-、NO3- | |
| D. | 0.1 mol/L Na2SiO3溶液中:K+、Cl-、NO3-、CO2 |
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3•mCu(OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水).
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
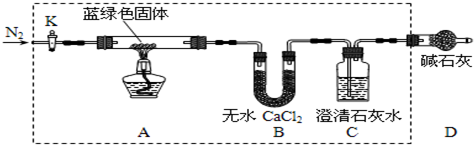
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设1成立.
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是B(填代号).
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(3)乙同学验证假设3成立的实验现象是A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生.
【定量探究】
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是AC(填代号)
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g•mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中的产生沉淀的质量为39.4g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2;A中发生的反应的化学方程式为2CuCO3•3Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$5CuO+3H2O↑+2CO2↑.
| A. | x=y | B. | x>y | C. | x<y | D. | 无法确定 |
| A. | 氢氧化钠和氢氧化铝都可治疗胃酸过多 | |
| B. | 葡萄酒中常含有一定量的S02用来防氧化和杀菌 | |
| C. | 酱油中含有三价铁可补充人体缺乏的铁元素 | |
| D. | 石油分馏的目的是为了获得乙烯、丙烯和丁二烯 |
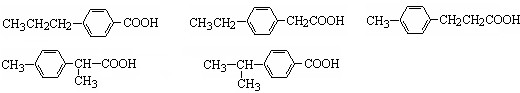 中任意两种.
中任意两种.

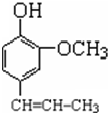 +CH3CH2Cl$\stackrel{一定条件下}{→}$
+CH3CH2Cl$\stackrel{一定条件下}{→}$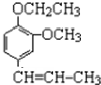 +HCl;
+HCl;