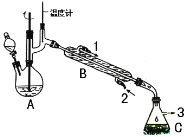
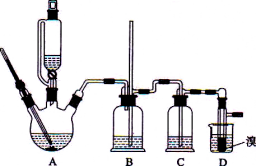题目内容
【题目】在有机反应中加氧去氢的反应叫氧化反应,去氧加氢的反应叫还原反应,如乙烯与氢气的加成反应也叫还原反应。1-苯乙醇因具有玫瑰香气味而广泛用于各种食用香精中,实验室用苯乙酮制备1-苯乙醇的反应、装置示意图和有关数据如下:

试剂[ | 熔点/℃[ | 沸点/℃ | 密度/g·cm-3 | 溶解性 | ||
水 | 乙醇 | 乙醚 | ||||
1-苯乙醇 | 20 | 203.4 | 1.013 | 不溶 | 溶 | 溶 |
苯乙酮 | 19.7 | 202.3 | 1.028 | 不溶 | 溶 | 溶 |
硼氢化钠 | 36 | 400 | 1.076 | 溶 | 溶 | 不溶 |
乙醇 | -117.3 | 78.4 | 0.789 | 溶 | - | 溶 |
乙醚 | -116.3 | 34.6 | 0.713 | 微溶 | 溶 | - |
实验步骤:
在A中加入15mL 95%的乙醇和1.0g硼氢化钠,搅拌下再滴入8mL苯乙酮,然后在搅拌的条件下,滴加足量的3mol·L-1的盐酸;使A中反应液的温度保持在75-80℃,使其中大部分乙醇蒸发,出现分层,再加入10mL乙醚。将混合反应液倒入分液漏斗中分液,水层再用10mL乙醚萃取,合并两次有机相,再进行简单蒸馏除去乙醚。最后经提纯收集到1-苯乙醇4.5g。
回答下列问题:
(1) 苯乙酮制备1-苯乙醇的反应类型是 ;
(2)仪器B的名称为______________;
(3)反应完成后,加入10mL乙醚,充分振荡后,上层为__________(填“水层”或“有机层”)
(4)反应中加入乙醇的目的是________________________________;
(5)两次合并的有机相进行蒸馏除去乙醚,采用的最佳加热方式是_________(填字母),若回收乙醚,则收集馏分的温度范围是____________________;
a.酒精为加热 b.水浴加热 c.油浴加热 d.酒精喷灯加热
(6)本实验的产率为_____________(保留两位有效数字)。
(7) 1-苯乙醇除用作香料外也用于有机合成,如1-苯乙醇与冰醋酸酯化反应制得乙酸苏合香酯,写出此反应化学反应方程式______________________________。
【答案】(1) 还原反应;(2)直形冷凝管;(3)有机层;(4)溶解硼氢化钠使反应物充分接触,加快反应速率; (5)b ;33~37℃;(6)54%;
(7) CH3COOH+ 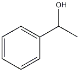
![]()
 +H2O
+H2O
【解析】
试题分析:(1)由苯乙酮制备1-苯乙醇的反应中羰基加氢发生了还原反应,故答案为:还原反应;
(2)仪器B是直形冷凝管,故答案为:直形冷凝管;
(3) 根据表中有机物密度分析,乙醚的密度小于水,其它有机物密度大于水,所以反应完成后,加入10mL乙醚,充分振荡后,上层为有机层,故答案为:有机层;
(4) 根据题中信息,苯乙酮不溶于水易溶于乙醇,要使硼氢化钠与苯乙酮充分反应,就要使它们能充分接触,所以用乙醇可以溶解硼氢化钠和苯乙酮,使反应物充分接触,故答案为:溶解硼氢化钠和苯乙酮,使反应物充分接触,加快反应速率;
(5) 乙醚的沸点只有34.6℃,所以可以用水浴加热的方式,若回收乙醚,则收集馏分的温度范围是35℃附近,故答案为:b ;33~37℃;
(6) 8mL苯乙酮的质量为8mL×1.028g/mL=8.224g,完全反应生成1-苯乙醇的质量为8.224g×![]() =8.361g,产率为
=8.361g,产率为![]() ×100%=54%,故答案为:54%;
×100%=54%,故答案为:54%;
(7) 1-苯乙醇与冰醋酸酯化反应制得乙酸苏合香酯,此反应化学反应方程式为CH3COOH+ 
![]()
 +H2O,故答案为:CH3COOH+
+H2O,故答案为:CH3COOH+ 
![]()
 +H2O。
+H2O。

 阅读快车系列答案
阅读快车系列答案