题目内容
【题目】乙醇、甲醚是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-256.1kJmol-1。
CH3CH2OH(g)+H2O(g) △H=-256.1kJmol-1。
已知:H2O(l)=H2O(g)△ H=+44kJmol-1 CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJmol-1
CO2(g)+H2(g) △H=-41.2kJmol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) △H=__________________kJmol-1
CH3CH2OH(g)+3H2O(l) △H=__________________kJmol-1
(2)把2molH2和1molCO通入1L的反应器中,一定条件下发生反应:
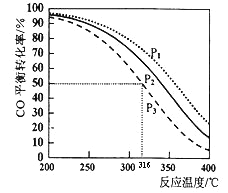
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图所示。
①以下能说明2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)达平衡状态的是___________
CH3OCH3(g)+H2O(g)达平衡状态的是___________
A.密度不再变化
B.CH3CH2OH蒸汽的体积分数不再变化
C.c(CO)/c(H2)不变
D.[c(CH3OCH3)c(H2O)]/[c(CO)c(H2)]不变
②图中的压强大小为: ,△H___________0(填“>”“<”或“=”),若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时反应的v(正)______v(逆)(填“>”“<”或“=”)。
③P3和316℃时反应的平衡常数________________
(3)汽车使用乙醇汽油并不能更加有效减少NOx的排放,气缸中生成NO的反应为:
N2(g)+O2(g)![]() 2NO(g) △H>0
2NO(g) △H>0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是_________________
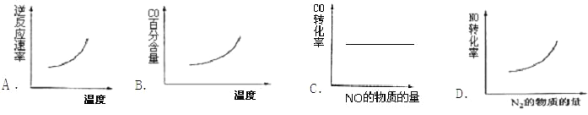
②汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
N2(g)+2CO2(g)△H=-746.8kJ/mol-1。在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是_______
(4)乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池负极的电极反应式为__________________。用该电池为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
2PbSO4+2H2O充电,充电一段时间后(假定两极充电前质量相等),测得两极质量差为6.4g时,通过电路电子的物质的量为__________________。
【答案】(1)△H=-305.7 kJmol-1
(2)①B ②P1>P2>P3 △H<0 v(正)<v(逆) ③0.25
(3)①速率加快,平衡正移 AB
(4)CH3CH2OH-12e-+6O2-=2CO2+3H2O 0.4mol
【解析】
试题分析:
(1)考查盖斯定律的应用。根据已知反应可知,①-③×2-②即得到2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l),所以该反应热是-256.1kJ/mol+41.2kJ/mol-44kJ/mol×3=-305.7kJ/mol。
CH3CH2OH(g)+3H2O(l),所以该反应热是-256.1kJ/mol+41.2kJ/mol-44kJ/mol×3=-305.7kJ/mol。
(2)①A.密度=质量÷体积,总质量总体积均不变,故密度一直不变,则密度不再变化不能作为是否达到平衡状态的判断依据;B.CH3CH2OH蒸汽的体积分数不再变化,可以判断;C.c(CO)/c(H2)一直不变,不能判断;D.[c(CH3OCH3)c(H2O)]/[c(CO)c(H2)]不变,不能判断。
②该反应压强增大,平衡向正反应方向移动,CO的转化率增大,结合图像可知压强P1>P2>P3;温度升高,CO的转化率减小,平衡向逆反应方向移动,可知反应为放热反应,△H<0;在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),根据三段式可得,此时CO转化率为80%,而平衡时CO转化率为50%,则可知反应应逆向移动,即v(正)<v(逆)。
③P3和316℃时,此时CO平衡转化率为50%,依据平衡三段式列式计算:
2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始量(mol/L) 1 2 0 0
变化量(mol/L) 0.5 1 0.25 0.25
平衡量(mol/L) 0.5 1 0.25 0.25
反应的平衡常数为K==0.25。
(3)①由于生成NO的反应为吸热反应,温度升高,反应速率加快,平衡右移,导致时间内NO排放量越大。
②该反应为气体体积缩小的放热反应。根据勒夏特列原理,升高温度,正逆反应速率均加快,平衡应向吸热方向(逆反应方向)移动,CO的百分含量增大,所以A、B选项均正确;增加NO的物质的量,平衡应向正反应方向移动,CO的转化率增大,故C错误;增加N2的物质的量(即增加N2的浓度),平衡应向逆反应方向移动,故NO转化率应减小,故D错误。选AB。
(4)原电池中负极失去电子,由于电解质能传递O2—离子,而在原电池中阴离子是向负极移动的,所以负极方程式为CH3CH2OH-12e-+6O2-=2CO2+3H2O。铅蓄电池充电时,阳极为PbSO4→PbO2,阴极为PbSO4→Pb,每转移2mol电子阳极质量减少64g,阴极质量减小96g,两极质量差32g。故当两极质量差为6.4g时,通过电路电子的物质的量为0.4mol。

 阅读快车系列答案
阅读快车系列答案