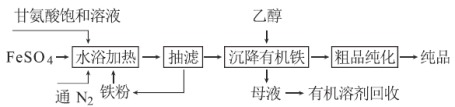
题目内容
【题目】一定温度下,在容积为V L的密闭容器中进行aN(g)![]() bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:
bM(g)的放热反应,M、N物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中=______。
(2)t2时两线交叉点__平衡状态(填“是”或“不是”),v正__v逆(填“>”“<” 或“=”)。
(3)此反应达到平衡时,反应物的转化率为____________。
(4)下列描述能说明上述反应达到平衡状态的是__________。
①反应中M与N物质的量之比为2∶5 ②混合气体的总物质的量不随时间的变化而变化③M的转化率达到最大 ④如容器为绝热容器,体系内温度不再变化
II某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色[因为发生N2O4(无色)![]() 2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
2NO2(红棕色)的反应],反应进行4 s时,NO2的浓度为0.04mol·L-1,再经过一段时间后反应达到平衡状态,这时容器内压强为开始时的1.8倍,则
(1)前4 s以N2O4浓度变化表示的平均反应速率为 。
(2)在4 s末时容器内的压强是开始时的 倍。
(3)平衡时容器内NO2的浓度是 。
【答案】I(1)2 (2)不是 > (3)75%(4)②③④
Ⅱ(1)0.005 mol·L-1·s-1 (2)1.2倍(3)0.16 mol·L-1
【解析】
试题分析:I、(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中a/b=2:1;
(2)t2时M、N的物质的量相等,但二者的物质的量仍然是变化的,因此两线交叉点不是平衡状态;此时反应物的物质的量仍然在减少,生成物的物质的量仍然在增加,因此反应向正反应方向进行,则v正>v逆。
(3)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,故N的转化率为![]() ×100%=75%;
×100%=75%;
(4)①反应中M与N物质的量之比为2∶5并不能说说明正逆反应速率相等,则不一定是处于平衡状态,①错误;②由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,②正确;③M的转化率达到最大时说明反应达到平衡状态,③正确;④如容器为绝热容器,体系内温度不再变化说明反应达到限度,④正确,答案选②③④。
Ⅱ、(1)前4 sNO2表示的反应速率是0.04mol/L÷4s=0.01 mol·L-1·s-1,反应速率之比是化学计量数之比,则以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1÷2=0.005 mol·L-1·s-1。
(2)在4 s末时生成NO2是0.04mol/L×10L=0.4mol,则根据方程式可知消耗N2O4是0.2mol,剩余N2O4是0.8mol,因此容器内的压强是开始时的![]() 倍。
倍。
(3) N2O4(无色)![]() 2NO2(红棕色)
2NO2(红棕色)
起始量(mol) 1 0
转化量(mol) x 2x
平衡量(mol) 1-x 2x
平衡时容器内压强为开始时的1.8倍,则![]() ,解得x=0.8,所以平衡时容器内NO2的浓度是1.6mol÷10L=0.16mol/L。
,解得x=0.8,所以平衡时容器内NO2的浓度是1.6mol÷10L=0.16mol/L。

 阅读快车系列答案
阅读快车系列答案