题目内容
【题目】锂电池应用很广,某种锂离子电池,其正极材料可再生利用。其正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6,现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
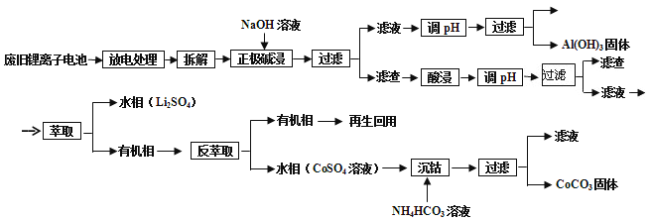
回答下列问题:
(1)写出“正极碱浸”中发生反应的化学方程式____________;
(2)“酸浸”一般在80℃下进行,写出该步骤中发生的主要氧化还原反应的化学方程式________________________;如果可用盐酸代替H2SO4和H2O2的混合溶液,可能发生反应的离子方程式___________________________;
(3)写出“沉钴”过程中发生反应的化学方程式______________________________;
(4)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出充电时正极的电极反应_____________________________________;
(5)在整个回收工艺中,可回收到的金属化合物有____________(填化学式);
(6)最近美国和韩国的科学家合作研究出新型锂—空气电池,他们的锂—空气电池在放电过程中产生稳定的晶状超氧化锂(LiO2),超氧化锂可以很容易地分解成锂和氧,从而具有更高的效率和更长的循环寿命。请写出该电池正极的电极反应 ____________。
【答案】(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2)2LiCoO2+3H2SO4+H2O2 = Li2SO4+2CoSO4+O2↑+4H2O
2CoO22++2Cl- +8H+ =2Co2++Cl2↑+4H2O
(3)CoSO4 + 2NH4HCO3 = CoCO3 ↓+ (NH4)2SO4 +CO2↑+ H2O (4)LiCoO2-xe- = Li1-xCoO2 + xLi+
(5)Al(OH)3、Li2SO4、CoCO3(或CoSO4);(6) O2 + e- + Li+ = LiO2
【解析】
试题分析:(1)正极中含有铝,铝易溶于强碱溶液生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,如果可用盐酸代替H2SO4和H2O2的混合溶液,LiCoO2能够将盐酸氧化生成氯气,2CoO22++2Cl- +8H+ =2Co2++Cl2↑+4H2O;故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,2CoO22++2Cl- +8H+ =2Co2++Cl2↑+4H2O;
(3)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
(4)充电过程中,正极的电极反应LiCoO2-xe- = Li1-xCoO2 + xLi+,故答案为:LiCoO2-xe- = Li1-xCoO2 + xLi+;
(5)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,根据流程图知,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4,故答案为:Al(OH)3、CoCO3、Li2SO4;
(6)锂—空气电池,正极氧气得到电子,电极反应为O2 + e- + Li+ = LiO2,故答案为:O2 + e- + Li+ = LiO2。

 名校课堂系列答案
名校课堂系列答案