题目内容
【题目】纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂。目前主要的合成方法有电解法、高温固相法等。
(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:
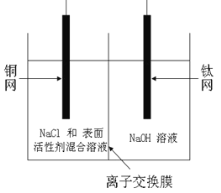
该电池的阳极反应方程式为 离子交换膜为_______(填阳或阴)离子交换膜,铜网应连接电源的_____极。
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O。
已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H = -846.3 kJ/mol
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157 kJ/mol
则该反应的热化学方程式是:__________。
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2 T1(填“﹥”“﹤”或“﹦”),原因是___________________。
②实验①前20 min的平均反应速率 v(O2)=
③比较不同方法制得的Cu2O的催化效果应选用__________组实验,原因是___________。
【答案】(1)2Cu-2e-+2OH-= Cu2O+H2O;阴;正;
(2)8CuO(s)+ CH4(g)=4Cu2O(s)+ CO2(g)+2H2O(g) ΔH=-266.3kJ/mol;
(3)①﹥;因为该反应的正反应方向为吸热方向,升温,平衡正向移动,平衡常数增大。③的平衡常数大于①,说明T2大于T1;②3.5×10-5 mol/(L·min) ;③①和②;除催化剂外,其他条件相同
【解析】
试题分析:(1)根据题意,铜电极发生氧化反应生成Cu2O,则铜网电极是阳极,钛网电极为阴极,阳极反应方程式为2Cu-2e-+2OH-= Cu2O+H2O,阴极上溶液中的氢离子放电,阳极区生成的氢氧根离子通过离子交换膜向阴极移动中和电荷,故答案为:2Cu-2e-+2OH-= Cu2O+H2O;阴;正;
(2)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H = -846.3 kJ/mol
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157 kJ/mol
根据盖斯定律,将②-③×8+①×4,得:8CuO(s)+ CH4(g)=4Cu2O(s)+ CO2(g)+2H2O(g) ΔH=(-846.3 kJ/mol)-(-157 kJ/mol)×8+(-169kJ/mol)×4=-266.3kJ/mol,故答案为:8CuO(s)+ CH4(g)=4Cu2O(s)+ CO2(g)+2H2O(g) ΔH=-266.3kJ/mol;
(3)①实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高所以T2>T1,故答案为:﹥;因为该反应的正反应方向为吸热方向,升温,平衡正向移动,平衡常数增大。③的平衡常数大于①,说明T2大于T1;
②实验①前20min的平均反应速率 v(H2O)=![]() =
=![]() =7×10-5 mol/(L·min),所以v(O2)=
=7×10-5 mol/(L·min),所以v(O2)=![]() ×7×10-5 mol/(L·min)=3.5×10-5 mol/(L·min),故答案为:3.5×10-5 mol/(L·min);
×7×10-5 mol/(L·min)=3.5×10-5 mol/(L·min),故答案为:3.5×10-5 mol/(L·min);
③比较不同方法制得的Cu2O的催化效果应选用①和②,因为除催化剂外,其他条件相同,故答案为:①和②;除催化剂外,其他条件相同。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案