题目内容
2.反应2X+Y?3Z+4W在四种不同情况下的反应速率可分别为:①υ(X)=0.5mol•L-1•s-1 ②υ(Y)=0.5mol•L-1•s-1
③υ(Z)=0.8mol•L-1•s-1 ④υ(W)=1mol•L-1•s-1
该反应进行由快到慢的顺序为②>③>①=④ (用序号填空).
分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质的反应速率与其化学计量数的比值越大,表示的反应速率越快.
解答 解:不同物质表示的速率之比等于其化学计量数之比,故不同物质的反应速率与其化学计量数的比值越大,表示的反应速率越快,
①$\frac{v(X)}{2}$=0.25mol•L-1•s-1;
②$\frac{v(Y)}{1}$=0.5mol•L-1•s-1;
③$\frac{v(Z)}{3}$=0.267mol•L-1•s-1;
④$\frac{v(W)}{4}$=0.25mol•L-1•s-1,
故反应速率:②>③>①=④,
故答案为:②>③>①=④.
点评 本题考查化学反应速率快慢比较,难度不大,常利用速率与其化学计量数比值大小比较或转化为同一物质表示的速率比较.

练习册系列答案
相关题目
13.下列比较正确的是( )
| A. | 稳定性:CH4>NH3>H2O>HF | B. | 熔沸点:CaO>BaO>NaCl>KCl | ||
| C. | 熔沸点:Na>Mg>Al | D. | 熔沸点:HF<HCl<HBr<HI |
10.某学习小组为探究原电池工作原理,设计如图装置,下列叙述不正确的是( )
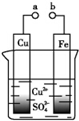

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
17.下列有关除杂质(括号内物质为杂质)的方法中,错误的是( )
| A. | 乙醇(水):加足量金属钠后,再蒸馏 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
7.NA表示阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 0.5mol H2O中含有的原子总数为1.5 NA | |
| B. | 0.2mol O2 所占有的体积为4.48L | |
| C. | 22g 二氧化碳气体中所含有的分子数目为0.5 NA | |
| D. | 100mL2mol/L的Na2CO3溶液中含有的Na+数目为0.4NA |
14.关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②可以贮存溶液;③使用之前要检查是否漏水;④能用来加热.这些叙述中正确的是 ( )
| A. | ①②③④ | B. | ②③ | C. | ①③ | D. | ②③④ |
7.一定条件下,等物质的量的N2和H2反应达平衡时,NH3的体积分数为40%,则下列叙述不正确的是( )
| A. | N2的转化率为28.57% | B. | H2的转化率为85.7% | ||
| C. | N2的体积分数为20% | D. | H2的体积分数为10% |
 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.