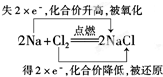
题目内容
12.在一定质量硫酸铝和硫酸锌组成的混合物中,SO42-的物质的量共2mol,若铝离子和锌离子的物质的量之比为2:1,则此混合物中硫酸锌的质量是80.5g.分析 设硫酸铝、硫酸锌的物质的量分别是xmol、ymol,若铝离子和锌离子的物质的量之比为2:1,则2x:y=2:1,硫酸根离子的物质的量=(3x+y)mol=2mol,联立方程组计算x、y值,再根据m=nM计算硫酸锌质量.
解答 解:设硫酸铝、硫酸锌的物质的量分别是xmol、ymol,若铝离子和锌离子的物质的量之比为2:1,则2x:y=2:1,硫酸根离子的物质的量=(3x+y)mol=2mol,联立方程组得$\left\{\begin{array}{l}{\frac{2x}{y}=\frac{2}{1}}\\{3x+y=2}\end{array}\right.$
解得$\left\{\begin{array}{l}{x=0.5}\\{y=0.5}\end{array}\right.$,则硫酸锌质量=0.5mol×161g/mol=80.5g,
故答案为:80.5.
点评 本题考查化学方程式有关计算,为高频考点,明确化学式中金属阳离子与酸根离子关系是解本题关键,熟悉物质的量有关公式的运用,题目难度不大.

练习册系列答案
相关题目
2.想一想:盐酸、75%的酒精溶液、氯水这些物质为什么归为一类,下列哪些物质还可以和他们归为一类( )
| A. | H2SO4 | B. | 胆矾 | C. | Fe(OH)3胶体 | D. | 液氯 |
3.在硫化氢的水溶液中,存在以下平衡:H2S═HS-H+、HS-═H++S2-,若使溶液的pH减小,则c(S2-)( )
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
20.在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度变为原来的60%,则( )
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率增大了 | ||
| C. | 物质B的质量分数减小了 | D. | a>b |
7.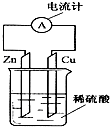 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 电流从铜片经导线流向锌片 | B. | 该装置将电能转变为化学能 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片发生还原反应 |
1.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | 标准状况下,22.4LH2O含分子数为NA | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 常温常压下,17g NH3含电子数目为10NA | |
| D. | 2.7g金属铝变成铝离子时失去的电子数为0.1NA |