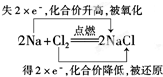
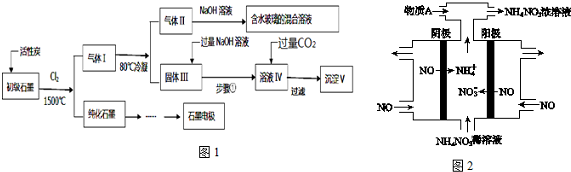
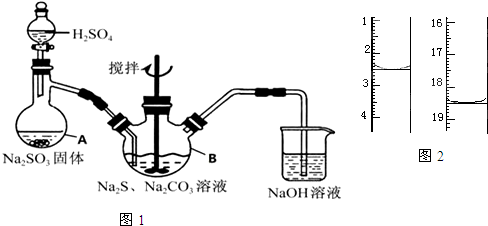
题目内容
13.下列比较正确的是( )| A. | 稳定性:CH4>NH3>H2O>HF | B. | 熔沸点:CaO>BaO>NaCl>KCl | ||
| C. | 熔沸点:Na>Mg>Al | D. | 熔沸点:HF<HCl<HBr<HI |
分析 A.非金属性越强,对应氢化物越稳定;
B.离子晶体中,电荷越大,离子半径越小,则晶体的熔沸点越大;
C.金属晶体中,金属阳离子半径越小,电荷越大,熔沸点越大;
D.HF中含氢键,沸点最大,分子晶体中相对分子质量越大,熔沸点越大.
解答 解:A.非金属性为F>O>N>C,则对应氢化物的稳定性为CH4<NH3<H2O<HF,故A错误;
B.均为离子晶体,CaO、BaO的电荷高,钙离子半径小于钡离子半径,钠离子半径小于钾离子半径,则熔沸点:CaO>BaO>NaCl>KCl,故B正确;
C.均为金属晶体,铝离子半径最小,电荷最大,则熔沸点:Na<Mg<Al,故C错误;
D.HF中含氢键,沸点最大,分子晶体中相对分子质量越大,熔沸点越大,则熔沸点:HCl<HBr<HI<HF,故D错误;
故选B.
点评 本题考查元素周期表及元素周期律的综合应用,为高频考点,把握晶体类型、熔沸点比较方法、稳定性比较方法等为解答该题的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
3.在硫化氢的水溶液中,存在以下平衡:H2S═HS-H+、HS-═H++S2-,若使溶液的pH减小,则c(S2-)( )
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
1.用NA表示阿伏加德罗常数,下列说法中正确的有( )
| A. | 标准状况下,22.4LH2O含分子数为NA | |
| B. | 1mol/L的CaCl2溶液中含Cl-的数目为2NA | |
| C. | 常温常压下,17g NH3含电子数目为10NA | |
| D. | 2.7g金属铝变成铝离子时失去的电子数为0.1NA |
18.下列关于钢铁腐蚀的叙述正确的是( )
| A. | 钢铁插入水中,水下部分比空气与水交界处更容易腐蚀 | |
| B. | 钢铁在海水中比在河水中更易腐蚀,主要是由于海水中有大量电解质 | |
| C. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| D. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |