题目内容
11.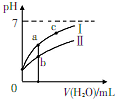 已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知下表为250C时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH.HC1O两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 向NaCl0溶液中通人少量二氧化碳的离子方程式为:2C1O-+CO2+H2O=2HClO+CO32- | |
| B. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | a、b、c三点所示溶液中水的电离程度:c>a>b | |
| D. | 图象中,I表示CH3COOH,Ⅱ表示HC1O,且溶液导电性:c>b>a |
分析 A.酸性强弱H2CO3>HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸;
B.酸电离平衡常数CH3COOH>HClO,则酸根离子水解程度ClO->CH3COO-,酸根离子水解程度越大,该离子在水溶液中浓度越小;
C.酸溶液中氢离子浓度越小,酸抑制水电离程度越小;
D.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸中离子浓度越大则酸溶液的导电性越强.
解答 解:A.酸性强弱H2CO3>HClO>HCO3-,根据强酸制取弱酸知,二者反应生成碳酸氢钠和次氯酸,离子方程式为ClO-+CO2+H2O═HClO+HCO3-,故A错误;
B.酸电离平衡常数CH3COOH>HClO,则酸根离子水解程度ClO->CH3COO-,酸根离子水解程度越大,该离子在水溶液中浓度越小,所以c(ClO-)<c(CH3COO-),ClO-、CH3COO-都水解导致溶液呈碱性但水解程度都较小,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故B错误;
C.酸溶液中氢离子浓度越小,酸抑制水电离程度越小,a、b、c三点溶液中C(H+)大小顺序是b>a>c,所以水电离程度c>a>b,故C正确;
D.pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以I表示CH3COOH,Ⅱ表示HClO,酸中离子浓度越大则酸溶液的导电性越强,所以溶液导电性:b>a>c,故D错误;
故选C.
点评 本题考查离子浓度大小的比较,侧重于弱电解质的电离的考查,为高频考点,根据酸的电离常数与酸根离子水解程度、酸的酸性强弱等知识点来分析解答,注意:溶液导电能力大小与溶液中自由移动离子成正比,与电解质强弱无关,为易错点.

| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不同 | |
| C. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 陶瓷刀大多是用一种纳米材料“氧化锆”为原料加工而成,具有硬度高、导热性好、抗腐蚀等优点 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“蔚蓝” |
| A. | 苯能使溴水褪色,发生取代反应 | |
| B. | 乙烯使高锰酸钾溶液褪色,发生加成反应 | |
| C. | 乙醇在红热铜丝的作用下,能发生氧化反应 | |
| D. | 葡萄糖在稀硫酸作催化剂,水浴加热条件下可以发生水解反应 |
| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
| A. | a=b时,c(H2C2O4)+c(H+)=c(C2O42-)+c(OH-) | |
| B. | a=$\frac{b}{2}$时,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| C. | a=2b时,2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| D. | a=3b时,c(Na+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) |
| A. | 将溶液蒸干最多可以得到4 mol NaCl | |
| B. | 将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4 | |
| C. | 向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量 | |
| D. | 若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1- |
| A. | 该反应为吸热反应 | B. | CO2中含α键又含π键 | ||
| C. | Na2CO3为离子晶体,只含离子键 | D. | 每消耗2.24LCO2生成0.4克金刚石 |