题目内容
【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=_______
(2)计算此反应在800C时的化学平衡常数K=_______
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正)_______V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:C(s)+O 2(g)= CO2(g) H=-393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= __________。
CO(g)+H2(g) H= __________。
【答案】0.005mol/(L·min) 0.429 (或3/7) < +175.3kJ/mol
【解析】
(1)前2min内,反应的氧化铜为0.04mol,则反应的CO为0.02mol,v(CO)=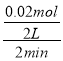 = 0.005mol/(L·min);
= 0.005mol/(L·min);
(2)平衡时,反应的氧化铜为0.06mol,则反应的CO为0.03mol,生成的CO2为0.03mol,在800C时的化学平衡常数K=![]() =
=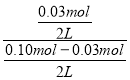 =0.429;
=0.429;
(3)若向平衡后的体系中加入CO和CO2各0.05mol,此时Qc=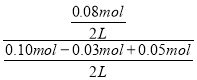 =0.667>K,平衡逆向移动,V(正)<V(逆);
=0.667>K,平衡逆向移动,V(正)<V(逆);
(4)已知:①C(s)+O 2(g)= CO2(g) H=-393.5kJ/mol,
②2CO(g)+O2(g)=2CO2(g) H=-566kJ/mol,
③2H2(g)+O2(g)=2H2O(g) H=-571.6kJ/mol,根据盖斯定律,将①-![]() (②+③),得:C(s)+H2O(g)
(②+③),得:C(s)+H2O(g)![]() CO(g)+H2(g) H=(-393.5kJ/mol)-
CO(g)+H2(g) H=(-393.5kJ/mol)-![]() [(-566kJ/mol)+( -571.6kJ/mol)]= +175.3kJ/mol。
[(-566kJ/mol)+( -571.6kJ/mol)]= +175.3kJ/mol。

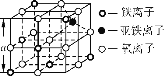
【题目】铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为________。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是__________;醋酸钠中碳原子的杂化类型是______。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因:___________。
物质 | N2H4 | NH3 |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)Fe3O4晶体晶胞如图所示,计算Fe3O4晶体的密度________g·cm-3。 (图中a=0.42 nm,计算结果保留两位有效数字)