题目内容
【题目】铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为________。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是__________;醋酸钠中碳原子的杂化类型是______。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因:___________。
物质 | N2H4 | NH3 |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
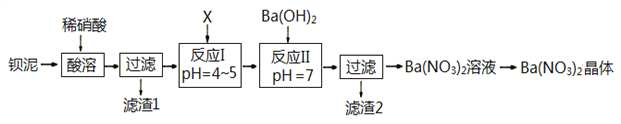
(4)Fe3O4晶体晶胞如图所示,计算Fe3O4晶体的密度________g·cm-3。 (图中a=0.42 nm,计算结果保留两位有效数字)
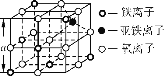
【答案】1s22s22p63s23p63d64s2或[Ar]3d64s2; O>N>C>H sp3、sp2 联氨分子间形成的氢键数多于氨分子间形成的氢键数 5.2
【解析】
(1)铁元素在周期表中是26号元素,基态原子的电子排布式为:1s22s22p63s23p63d64s2,可简写为[Ar]3d64s2,故答案为:1s22s22p63s23p63d64s2或[Ar]3d64s2;
(2)元素的非金属性越强,其电负性越大,非金属性O>N>C>H,则电负性O>N>C>H;甲基上C原子价层电子对个数是4、羧基上C原子价层电子对个数是3,根据价层电子对互斥理论判断C原子杂化方式为sp3、sp2,故答案为:O>N>C>H;sp3、sp2;
(3)从结构看,一个联氨分子可与6个分子形成氢键,而氨只能与4个分形成氢键。从表中得出氨(NH3)、联氨(N2H4)的熔沸点,氨低于联氨,其高低的主要原因:联氨分子间形成的氢键数多于氨分子间形成的氢键数。故答案为:联氨分子间形成的氢键数多于氨分子间形成的氢键数;
(4)该晶胞中氧离子个数=1+12×=4,Fe元素微粒个数=1+4×![]() +3×
+3×![]() =3;晶胞的边长程度为anm,则Fe3O4晶体的密度为=
=3;晶胞的边长程度为anm,则Fe3O4晶体的密度为=![]() =
=![]() g·cm-3=5.2g·cm-3。
g·cm-3=5.2g·cm-3。
故答案为:5.2g·cm-3。

【题目】某小组用实验 1验证FeCl3与 Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
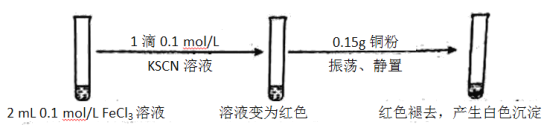
资料:ⅰ. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42—、Cu2+与Cl—。
ⅱ. SCN—被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与溴单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________。
(2)下列由实验1得到的推论中,合理的是__________。(填字母序号)
a.Cu能还原Fe3+
b.Fe3+与SCN—的反应是可逆反应
c.白色沉淀中的Cu(Ⅰ)(Ⅰ表示+1 价铜元素)可能是由 Fe3+氧化Cu 得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
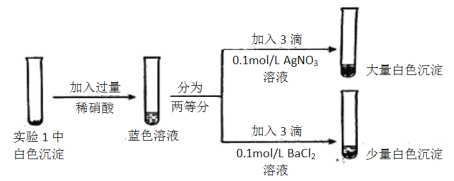
由实验2可知,实验1中白色沉淀的成分是__________。
(4)该小组欲进一步探究实验 1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 向2mL 0.1mol/L的FeCl3溶液中加入0.15g Cu粉 | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 |
Ⅱ | 取Ⅰ中上层清液于试管中,滴加 1滴 0.1mol/L KSCN溶液 | 有白色沉淀生成,且溶液出现红色 |
Ⅲ | 振荡Ⅱ中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤Ⅰ中反应的离子方程式为___________________。
②根据实验 3 的现象,小组同学认为 Fe3+与Cu 反应的氧化产物不含Cu(Ⅰ),他们的判断依据是_______________________________。
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是______________。
④解释步骤Ⅲ中实验现象产生的可能原因:___________。
【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=_______
(2)计算此反应在800C时的化学平衡常数K=_______
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正)_______V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:C(s)+O 2(g)= CO2(g) H=-393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= __________。
CO(g)+H2(g) H= __________。
【题目】已知:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=-1200 kJ·mol1。在2 L恒容密闭容器中,按照下表中甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%。下列说法中正确的是
甲 | 乙 |
0.2 mol NO2 | 0.1 mol NO2 |
0.4 mol CO | 0.2 mol CO |
A.放热反应,一定能自发进行
B.该温度下,反应的平衡常数为5
C.达平衡时,NO2的浓度:甲>乙
D.达平衡时,N2的体积分数:甲<乙