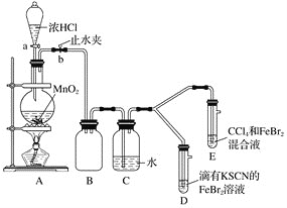
题目内容
【题目】C是一种常见的工业原料,实验室制备C的化学方程式如下,下列说法正确的( )
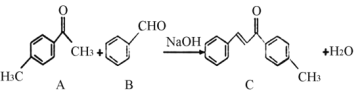
A.l mol的C最多能与7 mol的H2反应
B.分子C中所有碳原子一定共平面
C.可以用酸性KMnO4溶液鉴别A和B
D.A的同分异构体中含有苯环和醛基的结构有14种
【答案】D
【解析】
A.C中能与H2发生加成反应的有苯环、碳碳双键和羰基,则l mol的C最多能与8 mol的H2反应,A错误;
B.C含有饱和碳原子,具有甲烷的正四面体结构特征,因此不可能所有的碳原子在同一个平面上,B错误;
C.A中的甲基和B中的醛基,都可被酸性高锰酸钾氧化,因此不能用酸性高锰酸钾溶液鉴别A和B,C错误;
D.A的同分异构体中含有苯环和醛基,苯环可能含有2个甲基、1个醛基,有6种结构;如含有两个取代基,可为CH3CH2-、-CHO,也可为-CH3、-CH2CHO,各有邻、间、对3种结构,如含有1个取代基,可为-CH2CH2CHO或-CH(CH3)CHO两种结构,因此符合条件的同分异构体种类共有6+3+3+2=14种,D正确;
故合理选项是D。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目