题目内容
【题目】常温下,Mn+(指Cu2+或Ag+)的硫化物的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.直线MN代表CuS的沉淀溶解平衡
B.在N点Ksp(CuS)=Ksp(Ag2S)
C.P点:易析出CuS沉淀,不易析出Ag2S沉淀
D.M点和N点的c(S2-)之比为1×10-20
【答案】D
【解析】
A选项,N点c(S2-) = 1×10-20mol/L,c(Mn+) = 1×10-15mol/L,M点c(S2-) = 1×10-40mol/L,c(Mn+) = 1×10-5mol/L,如果直线MN代表CuS的沉淀溶解平衡,那么M点c(S2-)c(Mn+) = 1×10-40×1×10-5 =1×10-45,N点c(S2-)c(Mn+) = 1×10-20×1×10-15 =1×10-35,M点和N点的Ksp不相同,故A错误;
B选项,在N点硫离子浓度相等,金属离子浓度相等,但由于Ksp的计算表达式不一样,因此Ksp(CuS)>Ksp(Ag2S),故B错误;
C选项,根据A分析MN曲线为Ag2S的沉淀溶解平衡,P点Q<Ksp(CuS),Q>Ksp(Ag2S),因此不易析出CuS沉淀,易析出Ag2S沉淀,故C错误;
D选项,M点c(S2-) = 1×10-40mol/L,N点c(S2-) = 1×10-20mol/L,两者的c(S2-)之比为1×10-20,故D正确。
综上所述,答案为D。

 名校课堂系列答案
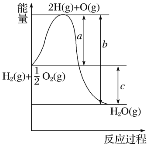
名校课堂系列答案【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=_______
(2)计算此反应在800C时的化学平衡常数K=_______
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正)_______V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:C(s)+O 2(g)= CO2(g) H=-393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= __________。
CO(g)+H2(g) H= __________。