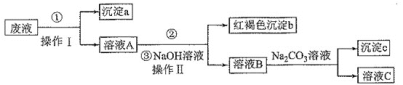
题目内容
【题目】下列物质的转化在指定条件下能实现的是
①Cu![]() Cu2(OH)2CO3
Cu2(OH)2CO3![]() CuO
CuO
②CaCl2(aq) ![]() CaCO3
CaCO3![]() CaSiO3
CaSiO3
③MgO![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl2(s)
MgCl2(s)
④N2![]() NO2
NO2![]() HNO3
HNO3
⑤Cl2![]() NaClO
NaClO![]() Cl2
Cl2
A.①④⑤B.①②⑤C.②③⑤D.①②④
【答案】B
【解析】
![]() 与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿失水变成氧化铜;
与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿失水变成氧化铜;
![]() 氨气溶于水为碱性溶液,增大了二氧化碳的溶解度生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙;
氨气溶于水为碱性溶液,增大了二氧化碳的溶解度生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙;
![]() 氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,加热促进其水解,最终得到氧化镁;
氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,加热促进其水解,最终得到氧化镁;
![]() 氮气与氧气与生成NO;
氮气与氧气与生成NO;
![]() 氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠与浓盐酸反应生成氯气,据此解答即可。
氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠与浓盐酸反应生成氯气,据此解答即可。
![]() 与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿加热分解生成二氧化碳、水和氧化铜,故
与空气中的氧气和水以及二氧化碳反应生成铜绿,铜绿加热分解生成二氧化碳、水和氧化铜,故![]() 能实现;
能实现;
![]() 氨气溶于水为碱性溶液,二氧化碳在碱性溶液中溶解度增大,与氯化钙反应生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙,故
氨气溶于水为碱性溶液,二氧化碳在碱性溶液中溶解度增大,与氯化钙反应生成碳酸钙,碳酸钙高温与二氧化硅反应生成硅酸钙,故![]() 能实现;
能实现;
![]() 氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,
氯化镁为强酸弱碱盐,氯化镁中存在镁离子的水解,![]() ,由于HCl具有挥发性,加热促进水解,最终得到氢氧化镁,氢氧化镁加强热,分解生成MgO,故
,由于HCl具有挥发性,加热促进水解,最终得到氢氧化镁,氢氧化镁加强热,分解生成MgO,故![]() 不能实现;
不能实现;
![]() 氮气与氧气在放电条件下反应生成NO,氮气与氧气在放电条件下不能反应生成NO2,故
氮气与氧气在放电条件下反应生成NO,氮气与氧气在放电条件下不能反应生成NO2,故![]() 不能实现;
不能实现;
![]() 氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠具有氧化性,浓盐酸具有还原性,两者发生归中反应生成氯气,故
氯气溶于氢氧化钠生成次氯酸钠,次氯酸钠具有氧化性,浓盐酸具有还原性,两者发生归中反应生成氯气,故![]() 能实现;故正确的是B,故选B。
能实现;故正确的是B,故选B。
①②⑤能够实现;
答案选B。

【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)