题目内容
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
【答案】减小 分子化 不变 酸 NH4++H2O≒NH3H2O 0.1 c(NH4+)+c(Cl-)=c(H+)+c(OH—) 酚酞溶液 当滴入最后一点盐酸溶液,溶液由浅红色变为无色且半分钟内不恢复为原色 0.1114
【解析】
:(1)由于(NH4)2SO4=2NH4++SO42-,溶液中NH4+浓度增大,抑制氨水电离,导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,所以此时溶液中液中中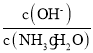 减小;
减小;
故答案为:减小;
(2)氨水中存在NH3+H2ONH3H2ONH4++OH-,向氨水中加入含有氢氧根离子的氢氧化钠固体抑制一水合氨电离,所以NH3H2O的电离平衡向分子化移动,在该过程中,温度不变,则电离平衡常数不变,
故答案为:分子化;不变;
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合后溶液中的溶质为NH4Cl,由于铵根会水解:![]() ,所以溶液显酸性;根据物料守恒可知 c(NH4+)+c(NH3H2O)=c(Cl-),混合后c(Cl-)=0.2 mol/L/2=0.1mol/L,所以c(NH4+)+c(NH3H2O)= 0.1mol/L;溶液中的电荷守恒为:c(NH4+)+c(Cl-)=c(H+)+c(OH—),
,所以溶液显酸性;根据物料守恒可知 c(NH4+)+c(NH3H2O)=c(Cl-),混合后c(Cl-)=0.2 mol/L/2=0.1mol/L,所以c(NH4+)+c(NH3H2O)= 0.1mol/L;溶液中的电荷守恒为:c(NH4+)+c(Cl-)=c(H+)+c(OH—),
故答案为:酸;![]() ;0.1;c(NH4+)+c(Cl-)=c(H+)+c(OH—)
;0.1;c(NH4+)+c(Cl-)=c(H+)+c(OH—)
(4)氢氧化钠与HCl恰好中和溶液的pH为7,可选择酚酞溶液做指示剂;滴定终点的现象为:当滴入最后一点盐酸溶液,溶液由浅红色变为无色且半分钟内不恢复为原色;第二组数据误差较大,应该舍弃,则另外两次消耗盐酸的平均体积为:V(HCl)=(27.83+27.85)/2=27.84mL,![]() =0.1114mol/L;
=0.1114mol/L;
故答案为:酚酞溶液;当滴入最后一点盐酸溶液,溶液由浅红色变为无色且半分钟内不恢复为原色;0.1114。