题目内容
【题目】在体积固定的2L的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2![]() 2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
2SO3;△H<0。当气体的物质的量减少0.2mol时反应达到平衡,在相同的温度下测得气体压强为反应前的8/9。下列有关叙述正确的是( )
A. 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B. 降低温度,正反应速率减小程度比逆反应速率减小程度大
C. 将生成物SO3通入过量BaCl2溶液中,得到沉淀的质量为233g
D. 达到平衡时,平衡常数为2.5
【答案】D
【解析】A.SO3的生成与SO2的消耗反应方向一致,不能作为判断化学平衡的依据,故A错误;B.降低温度,平衡向放热反应方向移动,即向正反应方向移动,则正反应速率减小程度比逆反应速率减小程度小,故B错误;C.设起始时通入的SO2为xmol,
2SO2(g)+O2(g)![]() 2SO3(g) 气体减少
2SO3(g) 气体减少
起始(mol) x 1 0 1
反应(mol) 0.4 0.2 0.4 0.2
平衡(mol) x-0.4 0.8 0.4
平衡混合气体通入过量BaCl2溶液中,SO3和氯化钡溶液反应生成硫酸钡沉淀,SO2和氯化钡溶液不反应,生成0.4mol硫酸钡白色沉淀,质量为93.2g,故C错误;D.平衡时气体压强为反应前的![]() ,即物质的量为反应前的
,即物质的量为反应前的![]() ,则
,则![]() =
=![]() ,解得x=0.8mol,则平衡常数K=
,解得x=0.8mol,则平衡常数K=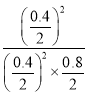 =2.5,故D正确;故选D。
=2.5,故D正确;故选D。

练习册系列答案
相关题目