题目内容
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属铜,保护环境。下列叙述错误的是( )
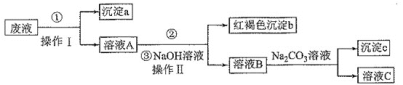
A.沉淀a中含有的单质是Cu、Fe
B.②的离子方程式是Fe2++H2O2+H+=Fe3++2H2O
C.操作Ⅱ用到的主要玻璃仪器有烧杯、漏斗、玻璃棒
D.溶液B中含有的阳离子主要是Ba2+、Na+
【答案】B
【解析】
酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出Cu,沉淀a为Fe、Cu混合物,溶液A含有Fe2+、Ba2+,然后在溶液A中加入H2O2、NaOH生成的红褐色沉淀为Fe(OH)3,溶液B含有Na+、Ba2+,向其中加入Na2CO3溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+,以此解答该题。
A.加入铁屑,可置换出铜,沉淀a为Fe、Cu,A正确;
B.溶液A含有Fe2+、Ba2+,然后在溶液A中加入H2O2,可以将Fe2+氧化为Fe3+,电子、原子不守恒,正确的反应的离子方程式应该为2Fe2++2H++H2O2=2Fe3++2H2O,B错误;
C.向加入②后的溶液中加入过量NaOH溶液,反应产生Fe(OH)3红褐色沉淀,然后过滤,过滤II用到的主要玻璃仪器有烧杯、漏斗、玻璃棒,C正确;
D.根据上述分析可知:溶液B含有Na+、Ba2+,D正确;
故合理选项是B。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目

