题目内容
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式___________________________________。
(2)肼(N2H4)可作为火箭发动机的燃料,与氧化剂 N2O4反应生成 N2 和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和 N2O4反应的热化学方程式___________________。
(3)饮用水中的 NO3-主要来自 NH4+。已知在微生物的作用下,NH 4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如图:
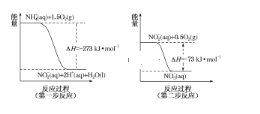
1mol NH 4+全部被氧化成 NO3-的热化学方程式为_______________________。
【答案】Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1 NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1
【解析】
(1) 1 mol Si的最高价氯化物为SiCl4,该化合物的熔、沸点分别为-69 ℃和58 ℃,则常温下呈液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol。
(2)①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
②×2-①即得肼和 N2O4反应的热化学方程式。
(3)从图中可以看出,两步反应都为放热反应,1mol NH 4+全部被氧化成 NO3-的热焓变,为图中两步反应的热焓变之和。
(1) 1 mol Si的最高价氯化物为SiCl4,该化合物的熔、沸点分别为-69 ℃和58 ℃,则常温下呈液态,该反应的热化学方程式为Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol。
答案为:Si(s)+2Cl2(g)=SiCl4(l) ΔH=-687 kJ/mol;
(2)①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
②×2-①即得肼和N2O4反应的热化学方程式为2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1,
答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-1048.9 kJ·mol-1;
(3)从图中可以看出,两步反应都为放热反应,1mol NH4+全部被氧化成NO3-的热焓变,为图中两步反应的热焓变之和。从而得出1mol NH4+全部被氧化成 NO3-的热化学方程式为NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1,
答案为:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案