题目内容
15. 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 | |
| C. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(CI{O}^{-})}$减小 |
分析 整个过程发生的反应为Cl2+H2O═HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,根据溶液的酸碱性结合电荷守恒和物料守恒分析解答.
解答 解:A.溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH,应选pH计,故A错误;
B.向a点所示溶液中通入SO2,氯气具有氧化性,能将二氧化硫氧化为硫酸,自身被还原为盐酸,酸性增强,漂白性减弱,故B错误;
C.c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故C正确;
D.由a点到b点的过程是氯气的溶解平衡Cl2+H2O?H++Cl-+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,溶液中$\frac{c({H}^{+})}{c(CI{O}^{-})}$增大,故D错误;
故选C.
点评 本题综合考查氯气的性质,为高频考点,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,根据物料守恒得c(Cl-)=c(ClO-)+c(HClO)为易错点,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
5.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
6.下列各项中实验的设计或操作能达到预期实验目的是( )
| 选项 | 实验目的 | 实验的设计或操作 |
| A | 比较Cl与S元素的非金属性强弱 | 相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH |
| B | 比较Ksp(AgCl)与Ksp(AgI)的大小 | 向AgCl浊液中滴入少量的KI溶液,振荡 |
| C | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| D | 证明氧化性H2O2比Fe3+强 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
3. 电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
 电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A. | 是原电池装置,把化学能转化为电能 | |
| B. | 是电解装置,只发生物理变化 | |
| C. | 左右池中得到淡水 | |
| D. | A膜是阴离子交换膜,B膜是阳离子交换膜 |
10.下列解释事实的方程式正确的是( )
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 电解饱和氯化钠溶液,产生气体:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ |
20.下列实验、现象及相关结论均正确的是( )
| A | B | C | D | |
| 实验 | 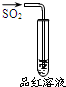 | 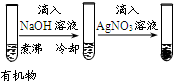 |  | 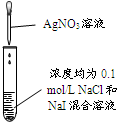 |
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30秒不复原 | 出现白色沉淀 |
| 结论 | SO2有强氧化性 | 有机物中含有溴原子 | 滴定达到终点 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
7.LED产品的使用为城市增添色彩.如图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
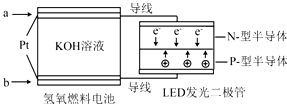

| A. | b处通入H2 | |
| B. | 该装置将化学能最终转化为电能 | |
| C. | 通入H2的电极发生反应:2H2-4e-=4H+ | |
| D. | a处为电池负极,发生了氧化反应 |
4.下列说法正确的是( )
| A. | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质 |