题目内容
13.(1)有关化学反应的能量变化如图1所示.合成氨用的氢气可以甲烷为原料制得,请写出CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.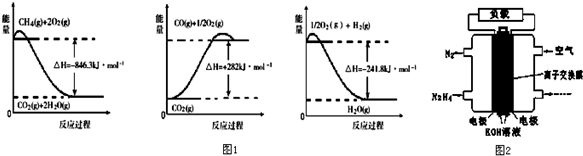
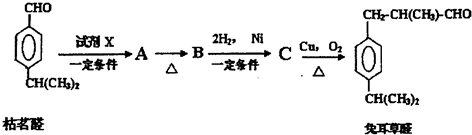
(2)液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图2所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.回答有关问题:
①电流从右侧电极经过负载后流向左侧电极(填“左或右”);
②负极发生的电极反应式为:N2H4+4OH--4e-=N2↑+4H2O
③该燃料电池的离子交换膜需选用阴离子交换膜(填“阳离子”或“阴离子”)
④常温下,用该电池电解400mL的饱和硫酸铜溶液(电极为惰性电极),电极表面水的电离平衡右移动(填“向左”“向右”或“不”);当消耗32mg液态肼时,电解后溶液的pH=2 (不考虑体积变化).
分析 (1)依据图象分析各个反应过程中能量变化情况,写出热化学方程式,依据盖斯定律计算CH4(g)与H2O(g)反应生成CO(g)和H2(g)的反应热,据此写出热化学方程式;
(2)该燃料电池中,负极上燃料失电子发生氧化反应,左侧为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,右侧为正极,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向,电子守恒规律分析解答①②③;
④用惰性电极电极硫酸铜,阳极上水电离产生的氢氧根离子失去电子发生氧化反应,促进水的电离;
串联电路中电解池、原电池中各个电极上通过的电量相等,依据消耗32mg液态肼时,计算各个电极上转移的电子的数目,依据电解池阳极发生反应4OH--4e-=2H2O+O2↑,计算消耗的氢氧根离子,进而计算生成的氢离子的物质的量和物质的量浓度,依据pH计算公式求溶液pH值.
解答 解:(1)由图象分析反应过程都是能量降低的过程,说明反应是放热反应;反应的热化学方程式分别为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
由盖斯定律①-③×3-②得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1;
(2)①该燃料电池中,负极上燃料失电子发生氧化反应,左侧为负极,右侧为正极,电流从正极出发经过负载流向负极,
故答案为:右;左;
②负极上燃料失电子发生氧化反应,左侧为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O;
故答案为:N2H4+4OH--4e-=N2↑+4H2O;
③该原电池中,正极上生成氢氧根离子,所以离子交换膜要选取阴离子交换膜,
故答案为:阴离子;
④惰性电极电极硫酸铜溶液时,水中氢氧根离子在阳极上放电,不断消耗,促进了水的电离,使水的电离平衡向右移动;
依据N2H4+4OH--4e-=N2↑+4H2O可知消耗32g肼转移4mol电子,所以消耗32mg液态肼时,转移电子数为0.004mol,电极池中4OH--4e-=2H2O+O2↑,转移0.004mol电子,消耗0.004molOH-,同时生成0.004molH+,所以C(H+)=$\frac{0.004mol}{0.4L}$=0.01mol,溶液的pH=-lg[H+]=2;
故答案为:右;2.
点评 本题考查了热化学方程式的书写、燃料电池、电解池工作原理,熟悉盖斯定律计算反应热的方法和燃料电池、电解池工作原理是解题关键,注意有关电化学计算中电子守恒的应用.

 阅读快车系列答案
阅读快车系列答案| A. | 硫酸镁晶体分解反应是放热反应 | B. | 氯化镁水解是熵增反应 | ||
| C. | 硫酸镁晶体分解反应是熵减反应 | D. | 氯化镁分解放热比硫酸镁少 |
| A. | NaCl、NaClO | B. | NaCl、NaClO3 | C. | NaClO、NaClO3 | D. | NaClO3、NaClO4 |
| A. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| B. | 25℃时,在 c(H+)=$\sqrt{{K}_{W}}$的溶液中,大量存在Na+、S2-、NO3-、CO32-等离子 | |
| C. | 常温,0.1mol•L-1的NaHSO3溶液的pH=6,则c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
工业上可用如下方法合成甲醇:
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为0.08mol/(L•min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=100.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.

(画在答题纸上)
④关于上述反应,下列叙述不正确的是A(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点减少二氧化碳的排放,有效控制温室效应.
(4)根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强320℃、0.2-0.6Mpa.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=$\frac{32C{\;}_{W}}{32C{\;}_{W}+9C{\;}_{M}}$.
| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
 一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )
一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是( )| A. | T1>T2,该反应的△H>0 | |
| B. | 加入催化剂可以提高CO的转化率 | |
| C. | T1时的平衡常数K1>T2时的平衡常数K2 | |
| D. | CO(g)+2H2(g)?CH3OH(1)的△H值将变大 |
 电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )
电渗析法是一种利用A、B离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )| A. | 是原电池装置,把化学能转化为电能 | |
| B. | 是电解装置,只发生物理变化 | |
| C. | 左右池中得到淡水 | |
| D. | A膜是阴离子交换膜,B膜是阳离子交换膜 |
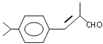 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.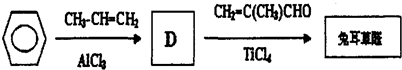
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.