题目内容
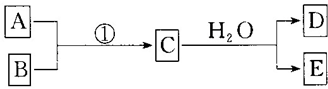
14.运用化学反应原理研究物质的性质具有重要意义.请回答下列问题;(1)氨气可以构成燃料电池,其电池反应原理为4NH3(g)+3O2(g)═2N2(g)+6H2O(g).电解质溶液为KOH,则负极的电极反应式为2NH3+6OH--6e-═6H2O+N2
(2)25℃时,将amol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-8}}{a-0.1}$;
(3)向BaCl2溶液中通CO2不会出现沉淀,请根据溶液中存在的平衡原理解释其原因不能生成沉淀,二氧化碳溶于水生成碳酸,碳酸电离出的碳酸根离子浓度很小,浓度商Q=c(Ba2+)×c(CO32-)<Ksp(BaCO3),某同学根据相同的理由认为向BaCl2溶液中通入SO2也不会出现沉淀,但在实验验证中发现了异常情况,将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间后出现了白色沉淀,则产生该沉淀的离子方程式为2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+
(4)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:SiO2(s)+2H2O(l)?H4SiO4(aq)△H
①写出该反应的化学平衡常数K的表达式K=c(H4SiO4)
②通常情况下,改变压强对气体会产生较大影响,对固体和液体影响很小.实际上,在地球的深处,由于压强很大,固体、液体受到的压强影响不能忽略.一定温度下,在10000m以下的地球深处,上述反应进行的方向是正方向(填“正方向”、“逆方向”或“不移动”),请根据平衡常数表达式解释其原因在压强很大的情况下,压强对固体、液体都会受到影响,平衡向物质的量少的方向移动.
分析 (1)氨气为碱性气体,易与酸反应,应用碱性电解质,正极上氧化剂得电子发生还原反应;
(2)①溶液中离子浓度关系满足c(NH4+)<c(Cl-)时,由电荷守恒可知c(H+)>c(OH-),溶液呈酸性性,结合选项根据反应物量的关系,判断溶液酸碱性;
②根据电荷守恒判断溶液中氢离子与氢氧根离子浓度的相对大小,进而判断溶液的酸碱性;溶液中存在平衡NH3.H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3.H2O),代入NH3•H2O的电离常数表达式计算.
(3)二氧化碳溶于水得到碳酸,碳酸微弱电离,根据浓度商和平衡常数的关系确定沉淀的产生与否;亚硫酸不稳定,容易被氧气氧化为硫酸,据此回答;
(4)①根据平衡常数表达式的定义书写,但二氧化硅是固体,水是纯液体不代入表达式;
②在压强很大的情况下,压强对固体、液体都会受到影响,所以平衡向体积减小的方向移动.
解答 解:(1)氨是燃料电池的负极,在碱性条件下,氨气与氢氧根反应生成氮气和水,氨气中氮的化合价由-3价升高到0价,2mol氨气失去6mol电子,电极反应式为2NH3+6OH--6e-═6H2O+N2,故答案为:2NH3+6OH--6e-═6H2O+N2;
(2)①溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,由电荷守恒可知c(H+)<c(OH-),溶液呈碱性,
a.盐酸不足,氨水剩余,为氯化铵与氨水的混合溶液,铵根离子水解程度小于氨水的电离时,溶液可能呈碱性,故a可能;
b.氨水与盐酸恰好完全反应,为氯化铵溶液,铵根离子水解,溶液呈酸性,故b不可能;
c.盐酸过量,溶液为氯化铵、盐酸的混合溶液,溶液呈酸性,故c不可能;
故选:a;
②根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=$\frac{1}{2}$×0.1mol•L-1=0.05mol•L-1,故混合后溶液中c(NH3.H2O)=$\frac{1}{2}$×amol•L-1-0.05mol•L-1=(0.5a-0.05)mol/L,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×0.05}{0.5a-0.05}$=$\frac{1{0}^{-8}}{a-0.1}$,故答案为:$\frac{1{0}^{-8}}{a-0.1}$;
(3)BaCl2溶液中通入二氧化碳没有沉淀生成,是因为二氧化碳溶于水生成碳酸,碳酸电离出的碳酸根离子浓度很小,浓度商Q=c(Ba2+)×c(CO32-)<Ksp(BaCO3);将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间后出现了白色沉淀,氧气将亚硫酸氧化成硫酸与氯化钡生成硫酸钡沉淀,所以离子方程式为:2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;
故答案为:不能生成沉淀,二氧化碳溶于水生成碳酸,碳酸电离出的碳酸根离子浓度很小,浓度商Q=c(Ba2+)×c(CO32-)<Ksp(BaCO3);2Ba2++2SO2+O2+2H2O═2BaSO4↓+4H+;
(4)①根据平衡常数表达式的定义书写,但二氧化硅是固体,水是纯液体不代入表达式,所以平衡常数K=c(H4SiO4),故答案为:K=c(H4SiO4);
②在压强很大的情况下,压强对固体、液体都会受到影响,所以平衡向体积减小的方向移动,即正反应方向移动,
故答案为:正方向;在压强很大的情况下,压强对固体、液体都会受到影响,平衡向物质的量少的方向移动.
点评 本题考查电极反应式的书写、电解质溶液中平衡常数的计算、化学平衡常数表达式的书写,平衡的移动、离子方程的书写以及根据方程式计算等知识,难度中等,综合性较强.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 阿司匹林课解热镇痛,常用于治疗感冒 | |
| B. | 氢氧化钠能中和胃酸,可用于治疗胃酸过多 | |
| C. | 蚕丝的主要成分是纤维素 | |
| D. | 合金中一定只含金属元素 |
| A. | 铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| B. | 向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
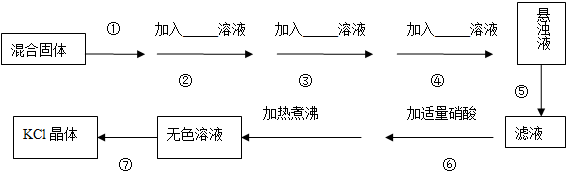
 (1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关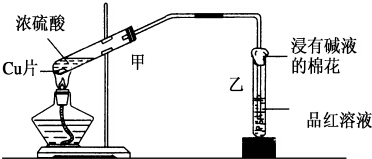 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.