题目内容
19.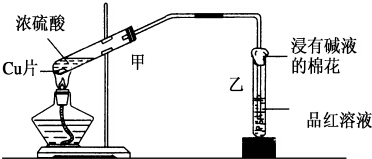 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.(1)写出甲装置中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)反应后品红溶液褪色,盛放品红溶液的试管口放一团浸有碱液的棉花,作用是吸收SO2,防止污染空气,反应的化学方程式2NaOH+SO2=Na2SO3+H2O.
(3)用铜片和铝片为电极,与电解质溶液构成原电池,回答相关问题.
①两极用导线连接同时插入稀硫酸中,铝片做负极,正极反应方程式为2H++2e-═H2↑.
②两极用导线连接同时插入浓硝酸中,铜片做负极,正极反应方程式为NO3-+e-+2H+═NO2↑+H2O.
分析 (1)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫能使品红褪色,浸有碱液的棉花可吸收过量的二氧化硫,防止污染环境;
(3)①插入稀硫酸中,Al为负极,正极上氢离子得到电子生成氢气;
②插入浓硝酸中,Cu为负极,正极上硝酸根离子得到电子生成二氧化氮.
解答 解:(1)Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,化学反应为Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)反应后品红溶液褪色,盛放品红溶液的试管口放一团浸有碱液的棉花,作用是防止吸收SO2,污染空气,反应的化学方程式为,
故答案为:褪色;吸收SO2,防止污染空气;2NaOH+SO2=Na2SO3+H2O;
(3)①插入稀硫酸中,Al为负极,正极上氢离子得到电子生成氢气,正极反应为2H++2e-═H2↑,故答案为:铝片;2H++2e-═H2↑;
②插入浓硝酸中,Cu为负极,正极上硝酸根离子得到电子生成二氧化氮,正极反应为NO3-+e-+2H+═NO2↑+H2O,故答案为:铜片;NO3-+e-+2H+═NO2↑+H2O.
点评 本题考查实验装置的综合应用及原电池等,综合性较强,把握实验原理、原电池原理为解答的关键,侧重化学反应原理的考查,题目难度不大.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
9.已知戊基共有八种,则分子式为C6H12O2的酸有几种( )
| A. | 3种 | B. | 4种 | C. | 8种 | D. | 6种 |
7.m A(g)+n B(g)?p c(g),在同一压强下变化如图,叙述正确的是( )
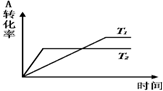

| A. | T1>T2,正反应是吸热反应 | B. | T1<T2,正反应是放热反应 | ||
| C. | T1<T2,正反应是吸热反应 | D. | T1>T2,正反应是放热反应 |
11.下列实验方案可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用BaCl2除去NaOH溶液中混有的少量Na2SO4 | |
| C. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
9.下列有关焰色反应叙述正确的是( )
| A. | 可用洁净的铁丝代替铂丝进行焰色反应 | |
| B. | 焰色反应是金属单质的特性 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 氯化钠在火焰上灼烧时火焰呈紫色 |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: