题目内容
6.已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系: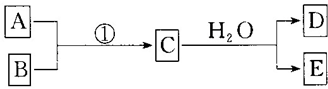
(1)若条件①为常温,B和D为同种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的稀溶液反应的离子方程式:Fe+4H++NO3-═Fe3++NO↑+2H2O.
(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则C为Al2S3(写化学式).
(3)若条件①为点燃,目前60%的B都是从海水中提取的,B常作铝热反应引发剂.气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O═3Mg(OH)2+2NH3↑.将气体D作为燃料电池的燃料源可以制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3-6e-+6OH-═N2+6H2O.
分析 (1)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和稀硝酸反应生成硝酸铁、一氧化氮和水.
(2)若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,据此答题.
(3)若条件①为点燃,目前60%的B都是从海水中提取的,则B是Mg,气体D可以使湿润的红色石蕊试纸变蓝,则D是NH3,C和水反应生成氨气和E,根据元素守恒知,A中含有氮元素,Mg和氮气能发生生成C为氮化镁,所以A是氮气,氮化镁和水反应生成氨气和氢氧化镁,据此写出反应方程式;碱性氨气燃料电池中,负极上氨气失电子发生氧化反应.
解答 解:(1)若条件①为常温,B和D为同-种无色气体,常温下E的浓溶液可以使Fe钝化,则E是硝酸,D是一氧化氮,C是二氧化氮,A是氧气,少量Fe粉和稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O.
(2)若条件①为加热,E是一种两性氢氧化物,则E是氢氧化铝,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则D是硫化氢,根据元素守恒知,C是硫化铝,
故答案为:Al2S3;
(3)若条件①为点燃,目前60%的B都是从海水中提取的,则B是Mg,气体D可以使湿润的红色石蕊试纸变蓝,则D是NH3,C和水反应生成氨气和E,根据元素守恒知,A中含有氮元素,Mg和氮气能发生生成C为氮化镁,所以A是氮气,氮化镁和水反应生成氨气和氢氧化镁,所以其反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;碱性氨气燃料电池中,负极上氨气失电子发生氧化反应,电极反应式为:2NH3+6OH--6e-=N2↑+6H2O,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;2NH3+6OH--6e-=N2↑+6H2O;
点评 本题考查了元素化合物的性质,正确推断物质是解本题关键,明确物质的特殊性质即可解答,难度中等.

| A. | 加入少量NaOH固体,电离平衡向正向移动 | |
| B. | 加入少量NaOH固体,溶液中的H+浓度增大 | |
| C. | 加入少量CH3COONa固体,电离平衡向正向移动 | |
| D. | 加入少量CH3COONa固体,溶液中的CH3COO-浓度减小 |
| A. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| B. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数约为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的物质的量浓度是相同的 |
| A. | 由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料 | |
| B. | 青铜、不锈钢、硬铝都是合金 | |
| C. | 铜表面易形成致密保护膜 | |
| D. | 装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低 |
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用BaCl2除去NaOH溶液中混有的少量Na2SO4 | |
| C. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
| A. | 加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 把氢氧化钠固体在烧杯中溶解后立即转移到容量瓶中,然后加水定容 | |
| C. | 除去蛋白质中混有的少量NaCl,加入AgNO3溶液后过滤 | |
| D. | 把装有二氧化氮和四氧化氮混合气体的烧瓶浸入到热水中气体颜色加深 |
| A. | 用托盘天平准确称量干燥的NaCl固体2.925 g | |
| B. | 准确称量2.9 g NaCl固体溶于500 mL蒸馏水 | |
| C. | 在500 mL 容量瓶中溶解氯化钠固体,然后加蒸馏水至刻度线 | |
| D. | 正确称量2.9 g混有KCl的NaCl固体,其他操作均正确,配好后的溶液中c(Cl-)偏低 |
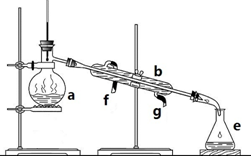 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏装置图:
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏装置图: