题目内容
3.下列离子方程式中正确的是( )| A. | 铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| B. | 向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
分析 A.反应生成硝酸铜、二氧化氮和水;
B.亚铁离子、溴离子均全部被氧化;
C.一水合氨在离子反应中保留化学式;
D.少量澄清石灰水完全反应,生成碳酸钙、水.
解答 解:A.铜与浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故A错误;
B.向FeBr2溶液中通入足量Cl2的离子反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
C.AlCl3溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;
D.Ca(HCO3)2溶液中加入少量澄清石灰水的离子反应为Ca2++OH-+HCO3-=CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
13.当光束通过稀豆浆时,可产生丁达尔效应,表明稀豆浆属于( )
| A. | 浊液 | B. | 溶液 | C. | 纯净物 | D. | 胶体 |
11.下列实验方案可行的是( )
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用BaCl2除去NaOH溶液中混有的少量Na2SO4 | |
| C. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
15.下列实验操作或实验所得出的结论一定正确的是( )
| A. | 加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 把氢氧化钠固体在烧杯中溶解后立即转移到容量瓶中,然后加水定容 | |
| C. | 除去蛋白质中混有的少量NaCl,加入AgNO3溶液后过滤 | |
| D. | 把装有二氧化氮和四氧化氮混合气体的烧瓶浸入到热水中气体颜色加深 |
12.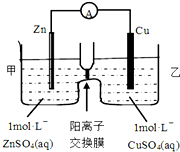 为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
 为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )| A. | 负极反应式:Ag+Cl-e-=AgCl | |
| B. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| C. | Na2Mn5O10是还原产物 | |
| D. | Cl-不断向电池的正极移动 |
13. 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 | |
| B. | 充电时,A为阴极,发生还原反应 | |
| C. | 放电时,B为正极,电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
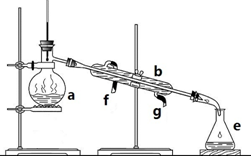 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏装置图:
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏装置图: 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: