题目内容
11.关于常温下pH均为12的氨水和氢氧化钠溶液,下列说法正确的是( )| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
分析 氢氧化钠为强电解质,而氨水为弱碱,存在电离平衡:NH3•H2O?NH4++OH-,则常温下pH=12的氨水和氢氧化钠溶液中,氨水的浓度大于NaOH溶液,溶液最后提供的氢氧化根离子多,恰好中和时,氨水消耗盐酸的体积较大,据此进行解答.
解答 解:A.NH3•H2O是弱电解质,在溶液中部分电离,所以氨水的浓度大于氢氧根离子的浓度,则氨水溶液的浓度大于氢氧化钠溶液,故A错误;
B.氨水为弱碱,存在电离平衡:NH3•H2O?NH4++OH-,将氨水体积稀释10倍,促进电离,溶液pH>11,故B错误;
C.氨水的总浓度大于溶液中氢氧根离子的浓度,等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多,故C正确;
D.氨水浓度较大,则氨水消耗盐酸的体积较大,将等体积的氨水和氢氧化钠用稀盐酸完全中和,氨水消耗盐酸多,所以消耗盐酸的体积不相同,故D错误;
故选C.
点评 本题考查了弱电解质的电离、酸碱混合的定性判断等知识,题目难度中等,明确弱电解质电离特点是解本题关键,注意掌握溶液酸碱性与溶液pH的关系,试题有利于提高学生灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法正确的是( )
| A. | 煤的气化和液化是高效、清洁地利用煤炭的重要途径 | |
| B. | 蚕丝的主要成分是纤维素 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水污染 |
16.下列实验操作能达到实验目的是( )
| A. | 用湿润的KI-淀粉试纸鉴别Br2(g)和NO2(g) | |
| B. | 用新制Cu(OH)2悬浊液鉴别乙醛和丙醛 | |
| C. | 将CH4与CH2=CH2混合气体依次通过酸性KMnO4溶液、浓硫酸可得到纯净的CH4 | |
| D. | 用托盘天平、量筒、烧杯、玻璃捧配制10%的NaCl溶液 |
9.硫酸具有重要的用途,某工厂用如图2示的工艺流程生产硫酸.
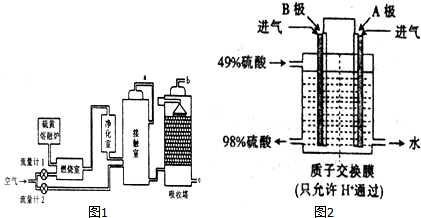
请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
该铵盐的成分是NH4HSO3和(NH4)2SO3,其物质的量之比是1:1.

请回答下列问题:
(1)与以硫铁矿为原料的生产工艺相比,该工艺的特点是A.
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)气体a的成分是二氧化硫和氧气.
(3)进入接触室的气体,须先经过净化室的原因是防止混合气体中的灰尘、水蒸气等在接触室中导致催化剂中毒.
①吸收塔中吸收SO3的物质名称是98.3%浓硫酸.
②以SO2和O2为原料,利用电化学原理也可以制备硫酸,装置如图2电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.B极的电极反应式为SO2-2e-+2H2O═SO42-+4H+.
③吸收塔排出的尾气先用氨水吸收,得到铵盐M,再用浓硫酸 处理M,得到较髙浓度的SO2.SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2时发生反应的离子方程式是SO2-2e-+2H2O═SO42-+4H+.
④为确定③中铵盐M的成分,将不同质量的铵盐分别加入50.00ml相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解),测得标准状况下NH3的体积如表:
| 铵盐的质量/g | 2.15 | 4.30 | 6.45 |
| NH3的体积/mL | 672 | 1344 | 1344 |
10.四种短周期元素X、Y、Z、W的原子序数依次增大.X与Z位于同一主族,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
| A. | Y的阳离子半径比W的阴离子半径小 | |
| B. | 气态氢化物的稳定性:X<Z<W | |
| C. | X、Z、W的氧化物对应的水化物的酸性强弱:X<Z<W | |
| D. | 室温下,含Y元素的盐形成的水溶液的pH<7 |
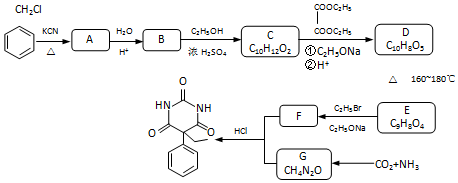
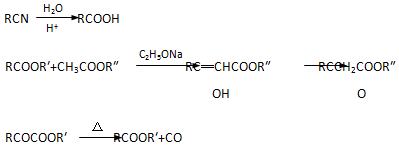
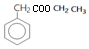 ;GCO(NH2)2.
;GCO(NH2)2.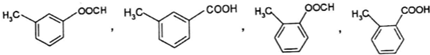 .
.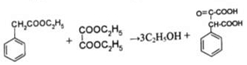 .
.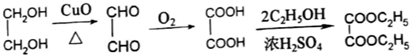 .
.