题目内容
15.某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收.其工业流程如图: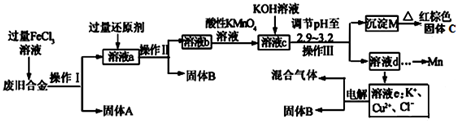
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是D
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是铜粉,溶液a中发生的反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为0.4xyg(用含x、y的代数式表示).
(4)将溶液c调节pH至2.9-3.2的目的是保证Fe3+沉淀完全而其他金属阳离子不沉淀.
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至4.5.
(6)工业上由红棕色固体C制取相应单质常用的方法是B
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑.
分析 含有Cu、Fe、Si废旧合金中的铁与铜与过量的氯化铁溶液发生氧化还反应,得到固体硅和含氯化铜、氯化亚铁和氯化铁的混合溶液a,加入过量的还原剂铜粉,得到时氯化亚铁和氯化铜的混合溶液b,然后向溶液中加入酸性高锰酸钾将亚铁离子氧化成铁离子,得到含锰离子、铁离子和铜离子的混合溶液中滴加氢氧化钾调节溶液的pH使铁离子完全沉淀,然后过滤得到氢氧化铁固体,灼烧得到氧化铁,溶液e电解阳氯离子放电得到氯气,阴极铜离子放电得到单质铜;
(1)根据操作Ⅰ、Ⅱ、Ⅲ分离得到的物质来判断;
(2)根据流程最后滤液中含铜,和电解得到B分析,加入过量的还原剂目的是还原过量的氯化铁;FeCl3具有氧化性与还原剂铜发生氧化还原反应,离子方程为:2Fe3++Cu=2Fe2++Cu2+;
(3)根据关系式和原子守恒可计算出C(Fe2O3)的质量;
(4)根据氢氧化物的沉淀PH进行分析,使氯化铁完全生成氢氧化铁;
(5)若要使Cu2+开始沉淀,Qc=Ksp,所以c(OH-)=$\root{2}{\frac{2.0×1{0}^{-20}}{0.2}}$=10-9.5mol/L,根据水的离子积常数,求出氢离子的浓度,从而求出pH;
(6)氧化铁与还原剂一氧化碳发生氧化还原反应得到单质铁;
(7)溶液e电解阳氯离子放电得到氯气,阴极铜离子放电得到单质铜.
解答 解:(1)通过操作Ⅰ、Ⅱ、Ⅲ都得到固体和溶液,所用该操作是过滤,过滤是把不溶性固体和溶液分开的操作,所以涉及过滤、洗涤、干燥,故选:D;
(2)根据流程最后滤液中含铜,和电解得到B分析,加入过量的还原剂目的是还原过量的氯化铁,故应加铜,FeCl3具有氧化性与还原剂铜发生氧化还原反应,离子方程为:2Fe3++Cu=2Fe2++Cu2+,故答案为:铜粉; 2Fe3++Cu=2Fe2++Cu2+;
(3)溶液b中含亚铁离子,会被酸性高锰酸钾氧化成铁离子,高锰酸钾被还原为锰离子,反应的离子方程式为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
根据关系式计算:
2 MnO4-~10Fe2+~5Fe2O3
2 10 5×160g
0.001xy m
m=$\frac{0.001xy×5×160g}{2}$=0.4xy,故答案为:0.4xy;
(4)因Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
溶度积常数越小,对应离子越易沉淀,所以沉淀顺序为:Fe3+>Cu2+>Mn2+,使氯化铁完全生成氢氧化铁,故答案为:保证Fe3+沉淀完全而其他金属阳离子不沉淀;
(5)若要使Cu2+开始沉淀,Qc=Ksp,所以c(OH-)=$\root{2}{\frac{2.0×1{0}^{-20}}{0.2}}$=10-9.5mol/L,所以pH=4.5,故答案为:4.5;
(6)氧化铁与还原剂一氧化碳发生氧化还原反应得到单质铁,所以用热还原法,故选:B;
(7)溶液e电解阳氯离子放电得到氯气,阴极铜离子放电得到单质铜,所以电极反应式为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故答案为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑.
点评 本题考查了实验方案的设计,设计实验基本操作,物质的分离与除杂,离子方程式的书写,沉淀溶解平衡及电解原理,题目较难,要考虑整个流程,从实验目的出发围绕问题根据化学原理一步步解答.

C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
H2O(g)═H2O(l)△H3=-c kJ/mol
若使92g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
| A. | 4a+4b+4c | B. | 2a-2b+6c | C. | 2a-2b+2c | D. | 2a-6b+2c |
| A. | 1 mol CH5+所含电子数为8nA | |
| B. | 标准状况下,11.2L Br2中Br原子数为nA | |
| C. | 1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA | |
| D. | 18g的D216O中含有的中子数为9 NA |
| A. | 甲烷 | B. | 乙烯 | C. | 乙烷 | D. | 苯 |
 在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示.下列说法不正确的是( )
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为5A+4B?4C | |
| B. | 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4 | |
| C. | 用B的浓度变化表示2min内的速率为2mol/(L•min) | |
| D. | 2min前,正反应速率逐渐减小,逆反应速率逐渐增大 |
| A. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| B. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2的数目为NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中,阴阳离子总数为0.3NA | |
| D. | 16.0g的过氧(根)离子中含有的电子数为9NA |
| A. | 0.05mol/(L•s) | B. | 0.05mol/L | C. | 0.20 mol/(L•s) | D. | 0.20mol/L |