题目内容
7.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 100mL 3.0mol/L的盐酸与5.6g铁屑完全反应转移的电子数为0.3NA | |
| B. | 含2mol H2SO4的浓硫酸与足量金属铜完全反应,产生SO2的数目为NA | |
| C. | 1L 0.1mol/L Na2CO3溶液中,阴阳离子总数为0.3NA | |
| D. | 16.0g的过氧(根)离子中含有的电子数为9NA |
分析 A、盐酸与铁屑发生反应生成氯化亚铁;
B、稀硫酸与铜不反应;
C、从CO32-水解的角度分析;
D、根据n=$\frac{m}{M}$结合过氧根离子的结构分析.
解答 解:A、盐酸与铁屑发生反应生成氯化亚铁,n(HCl)=0.3mol,n(Fe)=0.1mol,即盐酸过量,要根据铁的量来计算转移电子的物质的量,由于铁反应后变为+2价,故完全反应转移的电子数为0.2NA,故A错误;
B、含2molH2SO4的浓硫酸与足量金属铜完全反应,随着反应的进行,硫酸浓度不断减小,稀硫酸与铜不反应,则生成的SO2的数目小于NA,故B错误;
C、Na2CO3溶液中存在:CO32-+H2O HCO3-+OH-,则1L0.1mol/LNa2CO3溶液中,阴阳离子大于0.3NA,故C错误;
HCO3-+OH-,则1L0.1mol/LNa2CO3溶液中,阴阳离子大于0.3NA,故C错误;
D、n=$\frac{m}{M}$=$\frac{16g}{32g/mol}$=0.5mol,含电子的物质的量为0.5mol×(2×8+2)=9mol,所以含有的电子数为9NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
17.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
18.下列化合物中的化学键中,既有离子键又有共价键的是( )
| A. | H2O | B. | NaCl | C. | NH4Cl | D. | HCl |
2.关于各组溶液中微粒浓度的关系正确的是( )
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
19.工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)?2SO3(g).如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是( )
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
16.下列说法中正确的有的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成汽油 | |
| D. | 催化剂是决定化学反应速率的主要因素 |
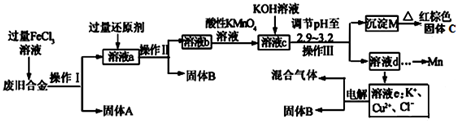
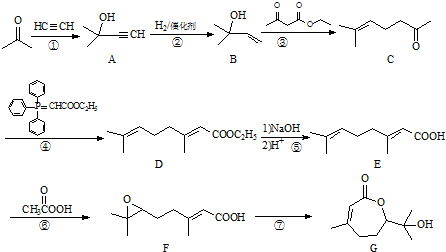
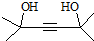 .
.
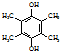
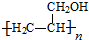 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.