题目内容
7.下列说法正确的是( )| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键 | |
| C. | 乙醇分子与水分子之间只存在范德华力 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
分析 A.氢化物的熔沸点随着原子序数增大而增大,但含有氢键的物质熔沸点较高;
B.氢键导致氢化物的熔点升高;
C.乙醇和水分子之间能形成氢键;
D.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强.
解答 解:A.HF中含有氢键,沸点最高,应为HF>HI>HBr>HCl,故A错误;
B.O的电负性较大,水分子间存在氢键,氢键较一般的分子间作用力强,则H2O的熔点、沸点大于H2S,故B正确;
C.乙醇分子与水分子之间存在氢键和范德华力,故C错误;
D.Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,应为HClO<HClO2<HClO3<HClO4,故D错误.
故选B.
点评 本题考查同一主族元素氢化物性质递变规律,侧重考查学生分析判断能力,明确氢键对物质熔沸点影响是解本题关键,注意氢键只影响物理性质不影响化学性质,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
17.下列离子方程式正确的是( )
| A. | 向盐酸中滴加氨水:H++OH-=H2O | |
| B. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | Na2SO3溶液中加入稀硝酸:SO32-+2H+=SO2↑+H2O |
18.下列各组物质,用一种试剂无法区别的是( )
| A. | 三种浓酸:HNO3、H2SO4、HCl | |
| B. | 四种无色溶液:(NH4)2SO4、NH4Cl、Na2SO4、NaCl | |
| C. | 四种黑色粉末:FeO、Fe、CuO、C | |
| D. | 四种无色溶液:KCl、NaOH、K2SO4、NaNO3 |
15.含有非极性键的共价化合物是( )
| A. | Na2O2 | B. | H2O2 | C. | H2 | D. | HCl |
2.下列有关电池的说法不正确的是( )
| A. | 锌锰干电池中,锌电极是负极 | |
| B. | 手机上用的锂离子电池属于二次电池 | |
| C. | 甲烷燃料电池可把化学能转化为电能 | |
| D. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
12.在一定条件下,某密闭容器中进行反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g).反应开始时NH3的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,容器体积不变,在这20s内H2O的化学反应速率为( )
| A. | 0.04 mol/(L•s) | B. | 0.06 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
19.用NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1mol冰中含氢键数为4NA | |
| B. | 12 g金刚石中含有C-C键的个数为4NA | |
| C. | 6 g SiO2晶体中硅氧共价键数为0.2NA | |
| D. | 常温下,100mLmol/LNa2CO3溶液中阴离子总数大于0.1NA |
16.有关化学用语正确的是( )
| A. | 过氧化钠的电子式: | B. | 乙醇的分子式C2H5OH | ||
| C. | 硫离子的结构示意图: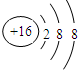 | D. | 乙酸的结构简式:C2H4O2 |
17.下列各组元素中,属于同一周期的是( )
| A. | C、O、S | B. | Li、Na、K | C. | Si、P、Cl | D. | F、Cl、Br |