题目内容
6.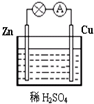 (1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,
(1)Zn极为原电池的负(填“正”或“负”)极,该极的电极反应式是Zn-2e-=Zn2+,属于氧化反应(填“氧化反应”或“还原反应”).Cu极的电极反应式是2H++2e-=H2↑,(2)该电池的总反应为Zn+2H+═Zn2++H2↑,电子(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中的H+从铜片(填“锌片”或“铜片”)获得电子.
(3)当导线中有1mol电子通过时,理论上正极的变化是:正极上析出1g 氢气.
分析 (1)锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子;
(2)铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电子流向从负极沿导线流向正极,溶液中阳离子移向正极;
(3)据正极电极反应式2H++2e-=H2↑计算.
解答 解:(1)锌铜原电池依据装置图分析,锌做负极失电子发生氧化反应生成锌离子,负极发生的反应是Zn-2e-=Zn2+,Cu为正极,氢离子在正极上得电子发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,
故答案为:负;Zn-2e-=Zn2+;氧化反应;2H++2e-=H2↑;
(2)该原电池反应原理是Zn+2H+═Zn2++H2↑,铜做正极,电子流向从负极沿导线流向正极,溶液中阳离子移向正极;
故答案为:Zn+2H+═Zn2++H2↑; 电子; 铜片;
(3)正极电极反应式2H++2e-=H2↑,有1mol电子通过时,生成0.5mol氢气,质量为1g,故答案为:1.
点评 本题考查了原电池原理的分析应用主要是电极反应,电极判断,电子流向,掌握基础是关键,题目较简单.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
16.有关化学用语正确的是( )
| A. | 过氧化钠的电子式: | B. | 乙醇的分子式C2H5OH | ||
| C. | 硫离子的结构示意图: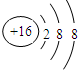 | D. | 乙酸的结构简式:C2H4O2 |
17.下列各组元素中,属于同一周期的是( )
| A. | C、O、S | B. | Li、Na、K | C. | Si、P、Cl | D. | F、Cl、Br |
14.已知1~18号元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数:c>b | B. | 氢化物的稳定性:H2Y<HZ | ||
| C. | 离子的还原性:Y2-<Z- | D. | 原子半径:r(X)<r(W) |
1.下列说法正确的是( )
| A. | 化学反应中的能量变化均表现为热量的变化 | |
| B. | 化学键的断裂和形成是化学反应中的能量变化的主要原因 | |
| C. | 需要加热才能够发生的反应一定是吸热反应 | |
| D. | 在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
11.下列各组物质中,都是共价化合物的是( )
| A. | H2O2和CaF2 | B. | H2S和Na2O2 | C. | HNO3和HClO4 | D. | NH3和N2 |
18.在可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大CO浓度 |
9.已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),则下列说法正确的是( )
| A. | 2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 | |
| B. | 将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
