题目内容
(15分)烧碱(NaOH)和纯碱(Na2CO3)与硫酸、盐酸和硝酸并称为工业上的“三酸两碱”。按要求回答下列问题:
(1)完成下列有关NaOH溶液参加反应的离子方程式
①向NaOH溶液中加入铝片:_______________________;
②向NaOH溶液中滴加少量氯化铝溶液___________________;
③二氧化氮与NaOH溶液发生氧化还原反应:___________________;
④用热的NaOH溶液洗涤沾有硫单质的试管:___________________;
(2)下列是碳酸钠和碳酸氢钠的性质比较,用“>”“<”“=”填空:
①热稳定性:Na2CO3_______NaHCO3;
②与稀盐酸反应快慢:Na2CO3_______NaHCO3;
③物质的量相同时,消耗盐酸的物质的量:Na2CO3_______NaHCO3。
(3)在10 mL 1 mol/L的纯碱溶液中,不断搅拌并逐滴加入10 mL 1.5 mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为____________L。
(4)碳酸钠在工业上具有广泛的作用,碳酸钠可以用作下列工业生产主要原料的是_____(填编号)
a.玻璃 b.水泥 c.造纸 d.海水提取镁
(1)2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
Al3++4OH-=Al(OH)4]- 2NO2+2OH-=NO3-+NO2-+H2O
3S+6OH- 2S2-+SO32-+3H2O(不写条件扣1分)
2S2-+SO32-+3H2O(不写条件扣1分)
(2) ①>;②<;③>(每空均为1分) (3)0.112 (4)a、c(每个1分,错一个倒扣1分)
解析试题分析:(1)①铝能和强碱氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
②由于氢氧化铝是两性氢氧化物,能溶解在强碱中,因此向NaOH溶液中滴加少量氯化铝溶液生成偏铝酸钠、氯化钠,反应的离子方程式为Al3++4OH-=Al(OH)4]- 。
③二氧化氮与NaOH溶液发生氧化还原反应生成硝酸钠、亚硝酸钠和水,反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O。
④在加热的条件下氢氧化钠溶液能溶解单质硫生成亚硫酸钠、硫化钠和水,因此用热的NaOH溶液洗涤沾有硫单质的试管发生反应的离子方程式为3S+6OH- 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。
(2)①碳酸氢纳加热易分解生成碳酸钠、水和CO2,所以热稳定性:Na2CO3>NaHCO3;
②碳酸钠与盐酸反应分步进行,即Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,因此与稀盐酸反应快慢:Na2CO3<NaHCO3;
③根据反应式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,物质的量相同时,消耗盐酸的物质的量:Na2CO3>NaHCO3。
(3)碳酸钠的物质的量=0.01L×1mol/L=0.01mol,盐酸的物质的量=0.01L×1.5mol/L=0.015mol。碳酸钠与盐酸反应分步进行,则
Na2CO3+HCl=NaCl+NaHCO3
0.01mol 0.01mol 0.01mol
此时还剩余盐酸的物质的量是0.005mol,则
NaHCO3 +HCl=NaCl+H2O+CO2↑
0.005mol 0.005mol 0.005mol
剩余实际生成的CO2是0.005mol
标准状况下的体积=0.005mol×22.4L/mol=0.112L
(4)工业生产玻璃的主要原料是纯碱、石灰石和石英;生产水泥的主要原料是黏土和石灰石;造纸主要原料是植物纤维,但需要用碳酸钠溶解纤维;海水中提取镁主要是一石灰石和盐酸为主要原料,因此答案选ac。
考点:考查氢氧化钠、碳酸钠的性质、用途以及有关方程式书写和计算等

某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| ①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| ②反应结束后分离出溶液备用。 | |
| ③红色固体用蒸馏水洗涤后,置于潮湿空气中。 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
按实验中发生反应的现象写出下列化学方程式(是离子反应的只写离子方程式)
①析出疏松的红色固体 ;
③一段时间后固体由红色变为绿色 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是 。
解释此现象的离子方程式是 、 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)
。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: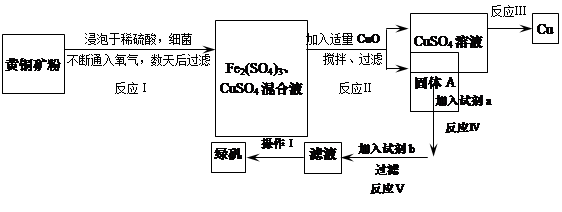
回答下列问题:
(1)已知:
| | Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(1)加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因 。
(2)写出能实现反应Ⅲ的化学方程式 。
(3)试剂b为 。
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、 、 。
(5)反应Ⅰ的化学方程式 。
(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式:
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 ③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式: ,
此法比直接用浓硫酸与铜反应有两个明显的优点:
。
(4)制备高纯硅的流程如下图:

写出石英砂制备粗硅的化学方程式:
。
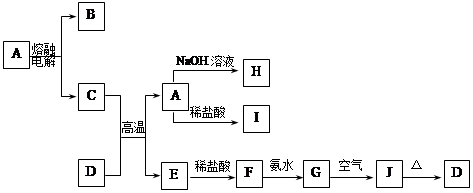
 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。