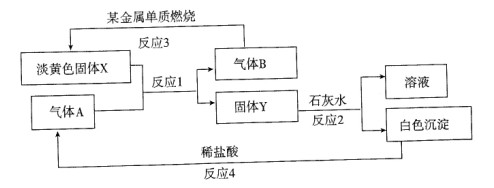
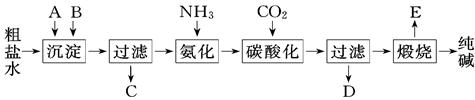
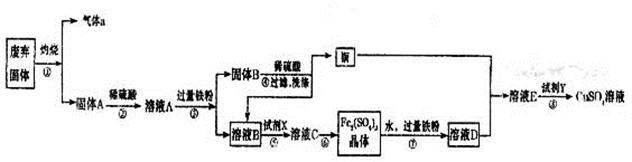
题目内容
氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
(1)上述五中物质中沸点最低物质的结构式为______________,由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为__________________(写一例)
(2)Al元素的单质有许多不同于其他金属的特性,请列举2例(也可以用化学方程式表示)
______________________、__________________________________.
(3)氢有3种稳定同位素,H氕、 D氘、 T氚,分别为丰度a、b、c,则计算氢元素的近似相对原子质量的表达式为______________________________________________.
甲认为H可以排在周期表ⅠA族,也可以排在ⅦA族;而乙同学认为H也可以与碳一样,排在ⅣA族,乙同学的理由是__________________________________________________。
(4)己知通入二氧化碳336 L(标准状况下),理论上生成Al(OH)3 ________________mol,
实际上生成24 mol Al(OH)3和15 mol Na2CO3,Al(OH)3比理论上要少的原因是:________________________________________________________.
(1)O=C=O 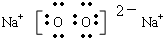 或 Na+[:H]-(2分)
或 Na+[:H]-(2分)
(2)被浓硫酸或浓硝酸钝化,能与强碱溶液反应放出氢气,发生铝热反应答出2例即可。
(2分)
(3)a+2b+3c ,最高正价与最低负价数值上相等(H的化合价+1,-1与碳+4,-4相似)(2分)
(4)30 ,氢氧化钠溶液处理铝土矿时,氢氧化钠过量,(铝酸钠的溶液中含有NaOH)并于CO2反应生成Na2CO3(2分)
解析试题分析:
(1)通常状况下,五种物质中只有CO2为气态,沸点最低;这五种物质中含有Na、Al、O、H、C五种元素,两种元素按原子个数比1:1形成的离子化合物有Na2O2、NaH。
(2)对比Al与其他金属的性质,答出Al的特性即可。
(3)元素的相对原子质量等于各同位素的相对原子质量乘以风度,然后求和;碳的最高正价为+4,最低负价为-4,H的最高正价为+1,最低负价为-1,绝对值相等。
(4)根据化学方程式可得:n[Al(OH)3]=2n(CO2)=2×336L÷22.4L/mol=30mol,上一步处理所用NaOH溶液是过量的,剩余的NaOH与CO2反应生成Na2CO3。
考点:本题考查结构式与电子式的书写、重要物质的性质、相对原子质量的计算、产量的计算。

(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”。
①M的原子结构示意图为______。
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为______。
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺。
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为____________
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为_______ (填序号)
| A.H2O2溶液 | B.铜粉 | C.稀硫酸 | D.KMnO4溶液 |
 4Fe(OH)3+8OH—+3O2
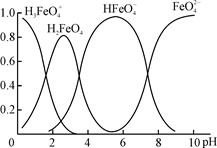
4Fe(OH)3+8OH—+3O2①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况。pH =4.74时,反应从开始到800min的平均反应速率v(FeO42—)=______ (保留两位有效数字)。
②图1在800min后,三种溶液中K2FeO4的浓度均不再改变。观察图1判断随着pH 变大,此反应的平衡常数______(填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热△H______0(填“>”、“<”、“=”)。

蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol·L-H2O2溶液,再调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C. 蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为 。
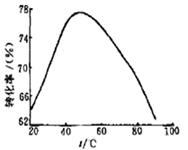
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率的关系如右图所示。
①步骤III中制备氢氧化镁反应的离子方程式为 。
②根据图中所示50 ℃前温度与Mg2+转化率之间 的关系,可判断此反应是
(填“吸热”或“放热”)反应。
③图中,温度升高至50 ℃以上Mg2+转化率下降的可能原因是 。
④ Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12Ca(OH)2(s)
 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。