题目内容
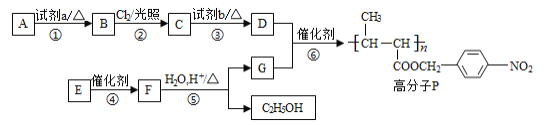
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
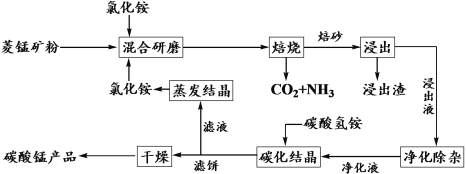
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时主要反应的化学方程式为__________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:_________________。

(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全。
(4)碳化结晶时,发生反应的离子方程式为___________,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(5)流程中能循环利用的固态物质是____________。
【答案】MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 500℃ m(NH4Cl)∶m(锰矿粉)=1.10 60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O 500℃ m(NH4Cl)∶m(锰矿粉)=1.10 60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 NH4Cl
MnCO3↓+CO2↑+H2O 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 NH4Cl
【解析】
根据流程图及题干信息菱锰矿(主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素)与氯化铵混合研磨,焙烧:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,浸出后Fe、Al、Ca、Mg得到相应的离子,浸出液的成分为:Mn2+、Mg2+、Ca2+、Fe2+、Fe3+、Al3+,加入MnO2将Fe2+氧化为Fe3+:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,再调节溶液的pH为5.2≤pH<8.8将Al3+、Fe3+变为沉淀除去,进一步除去Mg2+、Ca2+,得到的净化液主要含有Mn2+,加入碳酸氢铵发生反应:Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O,浸出后Fe、Al、Ca、Mg得到相应的离子,浸出液的成分为:Mn2+、Mg2+、Ca2+、Fe2+、Fe3+、Al3+,加入MnO2将Fe2+氧化为Fe3+:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,再调节溶液的pH为5.2≤pH<8.8将Al3+、Fe3+变为沉淀除去,进一步除去Mg2+、Ca2+,得到的净化液主要含有Mn2+,加入碳酸氢铵发生反应:Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O,过滤,滤饼干燥得到MnCO3产品,滤液的主要成分为氯化铵,蒸发结晶后可以循环使用,据此分析作答。
MnCO3↓+CO2↑+H2O,过滤,滤饼干燥得到MnCO3产品,滤液的主要成分为氯化铵,蒸发结晶后可以循环使用,据此分析作答。
(1)由分析可知,菱锰矿与氯化铵混合研磨,焙烧,主要发生方程式为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,故答案为:MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O,故答案为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(2)由图1可知,500℃之前的浸出率较低,再升高温度,浸出率变化很小,故氯化铵焙烧菱锰矿的最佳温度是500℃;由图2可知,氯化铵与菱镁矿粉的质量之比为1.10时浸出率较高,再增加氯化铵的用量,浸出率升高不明显,故氯化铵与菱镁矿粉的最佳质量之比为1.10;由图3可知焙烧60min,浸出率高,再增加焙烧时间,浸出率升高不明显,焙烧的最佳时间为60min;故答案为:500℃;1.10;60min;
(3)净化除杂中加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)由流程分析可知,碳化结晶是指锰离子与碳酸氢铵反应生成碳酸锰、二氧化碳和水,离子方程式为:Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2
MnCO3↓+CO2↑+H2![]() MnCO3+CO2↑+H2O;碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀;
MnCO3+CO2↑+H2O;碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀;
(5)由流程分析可知,最后滤液的主要成分为氯化铵,蒸发结晶后可以循环使用,故答案为:NH4Cl。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】某同学进行硫酸铜晶体(![]() )结晶水含量的测定实验。完成下列填空:
)结晶水含量的测定实验。完成下列填空:
(实验步骤):
(1)在__________(填仪器名称)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入一定量的硫酸铜晶体,并称重。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至_______(填仪器名称)中冷却到室温,并称重。
(4)重复上述实验进行恒重操作,其目的是_______________,直到两次称量结果不超过______克。
(5)下面是该学生实验的一次数据,请完成计算:
坩埚质量(克) | 坩埚与晶体的质量(克) | 恒重后坩埚与固体质量 |
13.721 | 24.692 | 20.631 |
![]() ______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
______;(精确到0.01)实验相对误差是_________(保留小数后一位)。
(6)这次实验中产生误差的原因可能是_______
a. 硫酸铜晶体中含有不挥发性杂质 b. 在加热过程中发现有黑色物质生成
c. 加热时有晶体飞溅出来 d. 加热失水后露置在空气中冷却