题目内容
【题目】功能高分子P的合成路线如下:
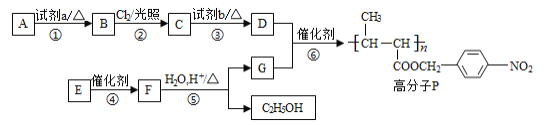
(1)A的分子式是C7H8,其结构简式是________。
(2)试剂a是_______。
(3)反应③的化学方程式:________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________。
(5)反应④的反应类型是________。
(6)反应⑤的化学方程式:________。
(7)已知:2CH3CHO ![]() 。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() (I)
(I)![]()
![]()
![]()
![]()
![]() (J)
(J)![]() E
E
【答案】![]() 浓硫酸和浓硝酸
浓硫酸和浓硝酸 ![]() +NaOH
+NaOH![]()
![]() +NaCl 碳碳双键、酯基 加聚反应
+NaCl 碳碳双键、酯基 加聚反应  +nH2O
+nH2O![]()
 +nC2H5OH CH3CH(OH)CH2CHO CH3CH=CHCHO
+nC2H5OH CH3CH(OH)CH2CHO CH3CH=CHCHO
【解析】
P为高分子化合物,D+G→P反应类型为取代反应或酯化反应,生成P的反应物是 和
和![]() ,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为
,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为![]() ,A→B应在甲基对位上引入-NO2,即B的结构简式为
,A→B应在甲基对位上引入-NO2,即B的结构简式为![]() ,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为
,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为 ,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为
,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为![]() ,G为
,G为 ,反应⑤发生水解,则F的结构简式为
,反应⑤发生水解,则F的结构简式为 ,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,据此分析;
,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,据此分析;
P为高分子化合物,D+G→P反应类型为取代反应或酯化反应,生成P的反应物是 和
和![]() ,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为
,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为![]() ,A→B应在甲基对位上引入-NO2,即B的结构简式为
,A→B应在甲基对位上引入-NO2,即B的结构简式为![]() ,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为
,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为 ,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为
,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为![]() ,G为
,G为 ,反应⑤发生水解,则F的结构简式为
,反应⑤发生水解,则F的结构简式为 ,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,
,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,
(1)A的分子式为C7H8,根据上述分析,A为甲苯,其结构简式为![]() ;
;
(2)根据上述分析,A→ B引入-NO2,则试剂a为浓硫酸和浓硝酸;
(3)根据上述分析,反应③发生水解反应,即反应方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
(4)E的结构简式为CH3CH=CH-COOC2H5,含有的官能团是碳碳双键和酯基;
(5)根据E和F的结构简式,推出反应④的类型为加聚反应;
(6)反应⑤发生酯的水解,其反应方程式为 +nH2O
+nH2O![]()
 +nC2H5OH;
+nC2H5OH;
(7)根据合成路线,以及已知信息,则I的结构简式为CH3CH(OH)CH2CHO,生成J条件是浓硫酸加热,发生消去反应,即J的结构简式为CH3CH=CHCOOH。

 名校课堂系列答案
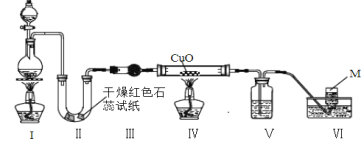
名校课堂系列答案【题目】PCl3主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
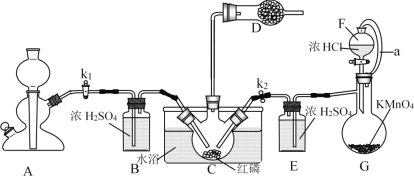
经查阅资料知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3。PCl3遇O2会生成POCl3(三氯氧磷),PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
回答下列问题:
(1)仪器G的名称是______。装置F与G由橡胶管a相连通,a的作用是_______。
(2)A是制取CO2装置,CO2的作用是_____,选择A中的药品是_____(填字母)。
a.稀盐酸 b.稀硫酸 c.NaHCO3粉末 d.块状石灰石
(3)装置D中盛有碱石灰,其作用是__________________。
(4)装置G中生成Cl2,反应的离子方程式为___________。
(5)装置C采用65-70℃水浴加热,制得的PCl3粗产品中常含有POCl3、PCl5等杂质,除杂的方法是:先加入红磷加热,除去PCl5,然后通过___________(填实验操作名称),即可得到较纯净的PCl3。
(6)通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取20.0 g PCl3粗产品,加水完全水解后,再配成500mL溶液;
第二步:移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 5molL-1碘溶液20mL,碘过量,H3PO3完全反应生成H3PO4;
第四步:加入几滴淀粉溶液,用1.0 molL-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12mL。
①第三步中反应的化学方程式为_____________。
②根据上述数据,计算该产品中PCl3的质量分数为______%。
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
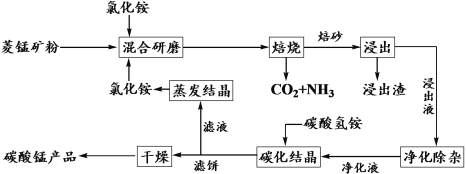
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时主要反应的化学方程式为__________________。
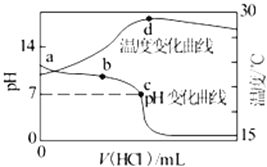
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:_________________。

(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全。
(4)碳化结晶时,发生反应的离子方程式为___________,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(5)流程中能循环利用的固态物质是____________。