题目内容
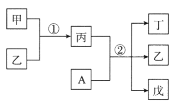
【题目】短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
A.简单离子半径:c>b
B.丙中既有离子键又有极性键
C.b、c形成的化合物中阴、阳离子数目比为1:2
D.a、b、d形成的化合物中,d的杂化方式是sp3
【答案】A
【解析】
短周期元素a、b、c、d的原子序数依次增大,常温下乙为液体,应该为H2O,则a为H元素,A为d元素组成的单质,且与丙反应生成水和常用于消毒、漂白的丁,则丙应为碱,由转化关系可知甲为Na2O,丙为NaOH,A为Cl2,生成丁、戊为NaCl,NaClO,可知b为O元素、c为Na元素、d为Cl元素,以此解答该题。
由以上分析可知a为H元素、b为O元素、c为Na元素、d为Cl元素,甲为Na2O、乙为H2O、丙为NaOH、丁为NaClO、戊为NaCl;
A.b、c对应的离子为O2-和Na+,具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径O2->Na+,即b>c,故A错误;
B.丙为NaOH,由Na+和OH-组成,则含有离子键和极性共价键,故B正确;
C.b为O元素、c为Na元素,两者组成的Na2O和Na2O2中阴、阳离子数目比均为1:2,故C正确;
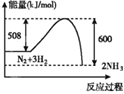
D.a、b、d形成的化合物中,若为NaClO,Cl原子的价电子对为1+![]() =4,则Cl的杂化方式是sp3;若为NaClO2,Cl原子的价电子对为2+
=4,则Cl的杂化方式是sp3;若为NaClO2,Cl原子的价电子对为2+![]() =4,则Cl的杂化方式是sp3;同理若为NaClO3或NaClO4,Cl原子杂化方式仍为sp3,故D正确;
=4,则Cl的杂化方式是sp3;同理若为NaClO3或NaClO4,Cl原子杂化方式仍为sp3,故D正确;
故答案为A。

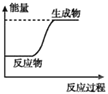
【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
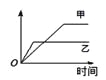
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D