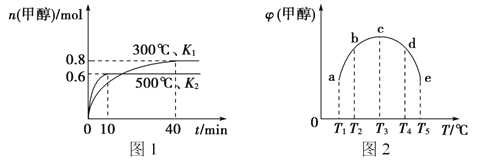
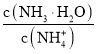题目内容
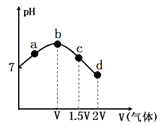
【题目】图Ⅰ是NO2(g)+CO(g)CO2(g)+NO(g)应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A.一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234kJ热量
B.若X表示温度,则Y表示的可能是CO2的物质的量浓度
C.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
D.若X表示反应时间,则Y表示的可能是混合气体的密度
【答案】B
【解析】
A.反应的焓变△H=E1E2=134kJ/mol368kJ/mol=234kJ/mol,又1molNO2(g)与1molCO(g)不可能完全反应到底,所以放出小于234kJ热量,故A错误;
B.该反应是放热反应,升温,化学平衡逆向进行,二氧化碳浓度减小,故B正确;
C.两种反应物的化学平衡,增加一种非固体物质的物质的量,会提高另一种转化率,故C错误;
D.气体形成的平衡体系中气体质量不变,反应前后体积不变,所以密度不变,故D错误;
故答案为:B。

 名校课堂系列答案
名校课堂系列答案【题目】下表是不同温度下水的离子积的数据:
温度 | 25 |
|
|
水的离子积 |
| a |
|
试回答以下问题
(1)若![]() ,则a______1×10-14填“<”“>”或“=”)。
,则a______1×10-14填“<”“>”或“=”)。
(2)250C时,某Na2SO4溶液中c(SO42-)=5×10-4mol/L,取该溶液1mL加水稀释至10mL,则稀释后溶液中![]() :
:![]() ______。
______。
(3)在![]() 温度下测得某溶液
温度下测得某溶液![]() ,该溶液显______
,该溶液显______![]() 填“酸”、“碱”或“中”
填“酸”、“碱”或“中”![]() 性
性![]() 将此温度下
将此温度下![]() 的NaOH溶液aL与
的NaOH溶液aL与![]() 的
的![]() 溶液bL混合,若所得混合液
溶液bL混合,若所得混合液![]() ,则a:b______。
,则a:b______。
(4)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL0.1 mol·L-1的HCl溶液和0.1 mol·L-1的CH3COOH溶液,得到如图所示的两条滴定曲线,请回答有关问题:
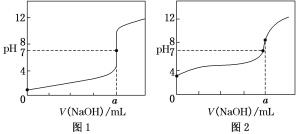
①0.1 mol·L-1的NaOH溶液滴定0.1 mol·L-1的CH3COOH溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
(5)某同学用0.1 mol·L-1的NaOH溶液分别滴定20.00 mL未知浓度的HCl溶液选用_______作指示剂,若装标准液的滴定管未润洗则会导致测定结果________(填“偏高”或“偏低”或“无影响”)
【题目】扁桃酸是唯一具有脂溶性的果酸,在医药工业可用于头孢羟唑、血管扩张药环扁桃酸酯、滴眼药羟苄唑、匹莫林等的中间体,也可作防腐剂。实验室用如下原理制备:
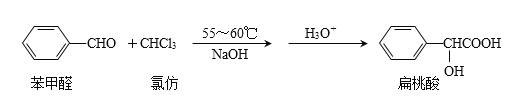
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
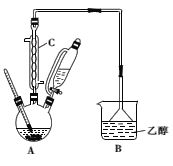
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。请回答下列问题:
(1)图中仪器C的名称是_________________,装置B的作用是_____________
(2)步骤一中合适的加热方式是_____________________。
(3)步骤二中用乙醚的目的是_____________________。
(4)步骤三中加入适量无水硫酸钠的目的是_____________________。
(5)该实验的产率为____________(保留三位有效数字)。
(6)扁桃酸在高端化学中也有很重要的作用,如以扁桃酸与正丁醇为原料,在催化剂的催化下可合成手性拆分剂扁桃酸正丁酯,试写出该反应的化学方程式___________。