题目内容
【题目】气体之间的反应有其独特的优点,对其研究具有重要意义。
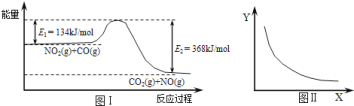
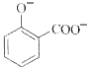
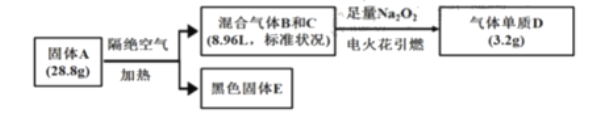
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。

在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__。
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g)![]() CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
CH3OH(g)在__(填“低温”、“高温”或“任意温度”)下能自发进行。
(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:_。
(4)计算图中A点的平衡常数Kp=__。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
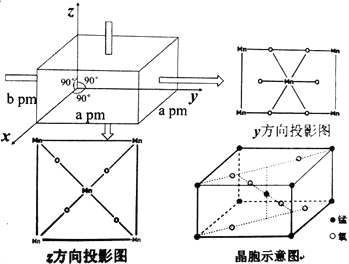
(5)已知NH3(g)+NOx(g)+O2(g)![]() N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
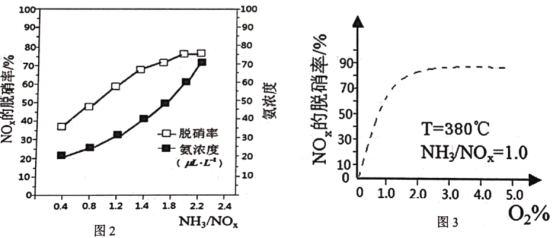 ①图2中,最佳氨氮比为2.0,理由是__。
①图2中,最佳氨氮比为2.0,理由是__。
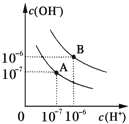
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示__。
【答案】BCD 低温 K(B)>K(C) = K(D) ![]() 氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,导致成产成本增多,低于2.0时,脱硝率随氨氮比增加而明显增大
氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,导致成产成本增多,低于2.0时,脱硝率随氨氮比增加而明显增大 
【解析】
⑴A. H2的消耗速率,正向进行,CH3OH生成速率,正向进行,同一个方向,因此不能说明达到平衡;B. CH3OH的体积分数不再改变,说明达到平衡;C. 密度等于气体质量除以容器体积,正向反应,气体质量不变,容器体积减小,密度不断减小,当混合气体的密度不再改变,则达到平衡;D. CO和CH3OH的物质的量之比保持不变,则说明达到平衡。
⑵判断反应ΔH,ΔS,根据ΔG = ΔHΔS<0判断。
⑶C、D温度相同,平衡常数相等,B温度比C温度低,判断K(B)、K(C)大小。
⑷根据温度相同,平衡常数相同,A点平衡常数与E点平衡常数相同,建立三段式算E点平衡常数。
⑸①根据图中信息氨氮比进行分析。
②使用催化剂与不使用,主要是反应速率加快,转化率不变,。
⑴A. H2的消耗速率,正向进行,CH3OH生成速率,正向进行,同一个方向,因此不能说明达到平衡,故A不符合题意;B. CH3OH的体积分数不再改变,说明达到平衡,故B符合题意;C. 密度等于气体质量除以容器体积,正向反应,气体质量不变,容器体积减小,密度不断减小,当混合气体的密度不再改变,则达到平衡,故C符合题意;D. CO和CH3OH的物质的量之比保持不变,则说明达到平衡,故D符合题意;综上所述,答案为BCD。
⑵从C点到A点,温度降低,转化率升高,平衡正向移动,降温向放热反应移动即正向放热反应,反应是体积减小反应ΔS <0,因此根据ΔG = ΔHΔS<0,得出CO(g)+2H2(g)![]() CH3OH(g)在在低温下能自发进行;故答案为:低温。
CH3OH(g)在在低温下能自发进行;故答案为:低温。
⑶C、D温度相同,K(C) = K(D),B温度比C温度低,反应是放热反应,因此降温正向移动,平衡常数增大,即K(B)>K(C),所以化学平衡常数K(B)、K(C)、K(D)的大小关系是:K(B)>K(C) = K(D)。
⑷根据温度相同,平衡常数相同,A点平衡常数与E点平衡常数相同,因此E点CO转化率为80%,则 ,因此E点的平衡常数
,因此E点的平衡常数 ,A点和E一样,故答案为:
,A点和E一样,故答案为:![]() 。
。
⑸①图2中,根据图中信息氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,因此增加成本较多,低于2.0时,脱硝率随氨氮比增加而明显增大,所以最佳氨氮比为2.0;故答案为:氨氮比为2.0到2.2,脱硝率变化不大,但氨浓度增加较大,导致成产成本增多,低于2.0时,脱硝率随氨氮比增加而明显增大。
②请在图3中,使用催化剂与不使用,主要是反应速率加快,转化率不变,因此用实线画出不使用催化剂情况下的图示与原来是一致的,只是把虚线变为实线,如图。
 ;故答案为:
;故答案为: 。
。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案