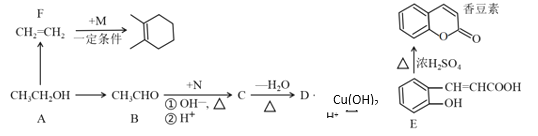
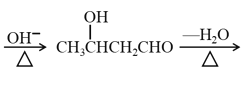题目内容
【题目】室温下,下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-)
B.0.1mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.2 mol/L
C.浓度均为0.1 mol/L的 ① NH4Cl ②NH4Al(SO4)2 ③ NH4HCO3三种溶液,其中c(NH4+):②>①>③
D.pH=11的NaOH溶液与pH =3的CH3COOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】C
【解析】
A.0.lmol/LNaHS溶液中存在电荷守恒:c(H+)+c(Na+)=2c(S2)+c(HS)+c(OH),故A错误;
B.0.1mol/LNa2CO3溶液中存在物料守恒:c(H2CO3)+c(![]() )+c(
)+c(![]() )=0.1mol/L,故B错误;
)=0.1mol/L,故B错误;
C.铝离子水解会抑制铵根离子水解,![]() 水解会促进铵根离子水解,铵根离子水解程度越大,则相同浓度铵盐溶液中铵根离子浓度越小,所以相同浓度的这三种盐中c(
水解会促进铵根离子水解,铵根离子水解程度越大,则相同浓度铵盐溶液中铵根离子浓度越小,所以相同浓度的这三种盐中c(![]() ):②>①>③,故C正确;
):②>①>③,故C正确;
D.醋酸是弱酸,pH=3的CH3COOH溶液中醋酸的物质的量大于0.001mol/L,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后醋酸过量,溶液显酸性,c(H+)>c(OH),根据电荷守恒可知c(CH3COO-)>c(Na+),因此溶液中离子浓度大小关系为:c(CH3COO-)>c(Na+)>c(H+)>c(OH),故D错误;
故答案为:C。

 阅读快车系列答案
阅读快车系列答案【题目】溶液X 中含有下表中离子若干种,且离子浓度均为相等(不考虑水的电离与离子水解)。向X 中加入足量稀盐酸,有无色气体生成, 经分析反应前后阴离子种类没有变化,下列说法正确的是
阳离子 | Na+、Ca2+ 、Fe3+、Fe2+、Al3+、Mg2+ |
阴离子 | OH-、 |
A.溶液X 中可能有![]() 或
或![]() 中的一种或两种都有
中的一种或两种都有
B.溶液X 中是否有Na+不能确定,需通过焰色反应来确定
C.溶液X 中可能有2 种阳离子,3 种阴离子
D.原溶液一定没有Al3+、Fe 3+,但Na+,、![]() 不确定
不确定
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如表
T/K | 938 | 1100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态、若降低温度,混合气体的平均相对分子质量__________________;充入氮气,混合气体的密度__________________(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1mol·的下列五种溶液的pH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,水解能力最弱的是__________________。
②根据表中数据判断,浓度均为0.01mol·L-1的下列四种物质的溶液分别稀释100倍,pH变化最小的是_______(填编号)
A. HClO B. HCN C.H2CO3 D. CH3COOH
③据上表数据,请你判断下列反应不能成立的是_______(填编号)
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B. CH3COOH+NaCN=CH3COONa+HCN
C. CO2+H2O+2NaClO=Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入碳酸氢钠,反应的离子方程式为______________
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀指示到达滴定终点当溶液中Cl恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为_______mol·L-1,此时溶液中c(CrO42-)等于_______mol·L-1.(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)