题目内容
11.下列反应中原子利用率高,符合“绿色化学”要求,无污染环境因素的是( )| A. | 乙烷与Cl2反应制氯乙烷 | B. | 乙醇和浓硫酸共热制乙烯 | ||
| C. | 乙酸和乙醇共热酯化 | D. | 乙烯与氧气在银催化作用下生成 |
分析 “绿色化学”就是要求原料物质中的所有原子完全被利用,全部转入期望的产物中,原子的利用率100%,无污染、无公害的化学,常见的反应类型有:化合反应、加成反应、加聚反应,据此即可解答.
解答 解:A.由乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷,1,1-二氯乙烷,1,2-二氯乙烷,1,1,2-三氯乙烷,1,1,2,2-四氯乙烷,1,1,1,2-四氯乙烷,1,1,1,2,2-五氯乙烷,六氯乙烷和氯化氢,产物不唯一,不符合绿色化学思想,故A错误;
B.CH3CH2OH$→_{170°C}^{浓硫酸}$CH2=CH2↑+H2O,还有水生成,原子的利用没有全部转入期望的产物中,不符合绿色化学思想,故B错误;
C.乙酸和乙醇在浓硫酸作用下加热CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH3+H2O生成乙酸乙酯和水,原子的利用没有全部转入期望的产物中,不符合绿色化学思想,故C错误;
D.乙烯与氧气在银催化作用下生成环氧乙烷 ,原子的利用全部转入期望的产物中,符合绿色化学思想,故D正确;
,原子的利用全部转入期望的产物中,符合绿色化学思想,故D正确;
故选D.
点评 本题考查了绿色化学,理解绿色化学的核心就是要利用化学原理从源头消除污染是解答的关键,题目较简单.

练习册系列答案
相关题目
1. 环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )
环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )
 环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )
环丙烷的结构简式可表示为△,而环已烷由于各个原子在空间的排列方式不同,有下列两种空间异构体.据此判断,当环已烷的不同碳原子上连有两个甲基(-CH3)时,包括甲基在六碳环上位置的不同和空间异构体在内,共有异构体的数目是( )| A. | 6种 | B. | 12种 | C. | 14种 | D. | 18种 |
2.原子电子层数相同的三种非金属元素A、B、C,已知最高价氧化物对应水化物的酸性HAO4>H2BO4>H3CO4,则下列判断错误的是( )
| A. | 非金属性:A>B>C | B. | 原子序数:A<B<C | ||
| C. | 原子半径:A<B<C | D. | 单质与氢气的化合能力:A>B>C |
19.下列叙述正确的是( )
| A. | 在共价化合物中一定存在共价键 | |
| B. | 只存在共价键的物质一定是共价化合物 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中只含有离子键 |
16.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液于另一试管中,加入几滴新制Cu(OH)2,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 检验葡萄糖中含有醛基 | 向3mL 2%氨水溶液中加入几滴2%的硝酸银溶液,再加入1mL10%的葡萄糖溶液温水浴加热几分钟 |
| D | 验证蛋白质的盐析 | 向豆浆、鸡蛋清溶液中均滴加饱和硫酸铵溶液,振荡至出现沉淀,再向沉淀物中加入蒸馏水,不断振荡 |
| A. | A | B. | B | C. | C | D. | D |
3.对于Zn与稀硫酸的反应,下列叙述不正确的是( )


| A. | 反应过程中能量关系可用如图表示: | |
| B. | 若将该反应设计成原电池,锌为负极 | |
| C. | 若将该反应设计成原电池,正极可用石墨 | |
| D. | 若将其设计为原电池,当有32.5 g锌溶解时,正极放出的气体一定为11.2 L |
20.下列不能证明反应N2(g)+3H2(g)?2NH3(g)已达到化学反应的限度的是( )
| A. | v正(NH3)=3v逆(H2) | |
| B. | 1个N≡N键断裂的同时有6个N-H键断裂 | |
| C. | 反应体系压强不再变化 | |
| D. | 混合气体质量不再变化 |
1.下列有关说法合理的是( )
| A. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| B. | 用50ml酸式滴定管可准确量取25.00ml KMnO4 溶液 | |
| C. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| D. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比为2:1 |
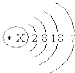 已知溴原子的原子结构示意图如图﹕
已知溴原子的原子结构示意图如图﹕